

6.下表反映出20世纪下半期世界各文明政治控制的领土数量发生变化,对此表信息解读正确的是 各文明政治控制的总领土估算(单位:万平方英里)
|
年份 |
西方文明 |
中华文明 |
伊斯兰文明 |
东正教文明 |
|
1971 |
1280.6 |
393.6 |
918.3 |
1034.6 |
|
1993 |
1271.1 |
392.3 |
1105.4 |
716.9 |
--摘自萨缪尔·亨廷顿《文明的冲突与世界秩序的重建》
(注:东正教地区包括欧洲东部、亚洲西部和北非东部,在种族上以斯拉夫人为主体。)
A.伊斯兰教极端势力的控制范围日益扩大
B.苏联解体、东欧剧变是导致变化的重要因素之一
C.西方国家政治稳定,没有出现民族分离运动
D.中华文明圈内各国和谐共进,变化微弱
5.“一大批过去被人瞧不起的中小国家现在终于在联合国内团结起来,向霸权主义和强权政治发起了挑战,改变了超级大国控制联合国的局面。”下列事件中最能验证这一现象的是
A.中国恢复在联合国的合法席位 B.亚非新兴民族独立国家召开万隆会议
C.国际经济政治新秩序得以建立 D.第一次不结盟国家和政府首脑会议的召开
4.“通过加强经济和社会的协调和建立经济和货币联盟,……促进经济和社会平衡和持续的进步;……特别通过……共同外交和安全政策,在国际舞台上表明其同一性……”以上条文的出台
A.表明欧洲走上了联合的道路 B.标志着北约组织的建立
C.标志着不结盟运动形成 D.推动多极化趋势进一步发展
3.“在今天的情况下,共产党俄国和它的盟国中国在政治体制上对东南亚施加的影响,不管它们采取的是哪一种手段,对整个自由世界来说都将是一种严重的威胁。美国认为不能消极地来承认这种可能性,而是应该采取联合行动来对付它……”在此思想影响下,美国
A.发动冷战遏制苏联等社会主义国家 B.借助马歇尔计划援助东南亚诸国
C.制造局部战争维护其地区霸权 D.以“联合国军”名义干涉他国内政
2.“划分欧洲势力范围的最后一幕,在一九六一年八月十三日凌晨上演。西柏林人一觉醒来,发觉自己等于成为牢中囚徒。”这幅场景反映了
A.德国被分区占领 B.柏林墙的修筑 C.两个德国的建立 D.古巴导弹危机
1.1946年,斯大林对苏联《真理报》记者说:“他的演说是危险的行动,……是站在战争挑拨者的立场上的……他不是孤独的,不仅在英国有朋友,而且在美国也有朋友。”斯大林所说的“他”是
A.杜鲁门 B.罗斯福 C.丘吉尔 D.马歇尔
21.(11分)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2 + Na2CO3 == NaNO2 + NaNO3 + CO2↑ ①
NO + NO2 + Na2CO3 == 2NaNO2 + CO2↑ ②
⑴配制1000g质量分数为21.2%的纯碱吸收液,需Na2CO3·10H2O g;
⑵现有1000g质量分数为21.2%的纯碱吸收液,在20℃经充分吸收硝酸工业尾气后,测得吸收液中NaNO2和NaNO3物质的量之比为5:3(不考虑NO、 NO2与水的反应),
① 硝酸工业尾气中NO、 NO2的物质的量之比为 ;
② 若将反应后的溶液,蒸发掉688g水,冷却到0℃,最多可析出NaNO2多少克?(0℃时,NaNO2的溶解度为71.2g/100g水)
20.(15分)下表是元素周期表的一部分。
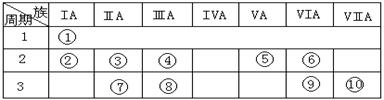
⑴下列说法正确且能说明元素⑩的非金属性比元素⑨强的是 。
A.同温同压下,元素⑩的气态氢化物溶解度大于元素⑨的气态氢化物
B.元素的最高价氧化物对应的水化物的酸性⑩强于⑨
C.元素⑨和⑩的单质与铁反应分别得到低价、高价铁的化合物
D.元素⑩的电负性大于元素⑨
⑵某元素原子的核外p电子数比s电子数少1,则该元素的元素符号是 ,与该元素单质分子互为等电子体的二价阴离子是 。
⑶已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质。写出元素③的氢氧化物与盐酸反应的离子方程式:
。
⑷上述元素⑦形成的晶体对应的晶胞为下图中的___________________(填写序号)。
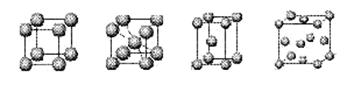
甲 乙 丙 丁
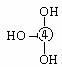 ⑸元素④的含氧酸的结构式可表示为 则可判断该酸为 酸(填强或弱)
⑸元素④的含氧酸的结构式可表示为 则可判断该酸为 酸(填强或弱)
一分子该酸与水作用,只能产生1个H+,请写出该酸溶于水后溶液显酸性的离子方程式 。
⑹已知元素⑧气态氯化物的化学式为R2Cl6,结构式如下,试并标出其中的配位键
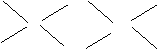 Cl
Cl
Cl
Cl
Cl
Cl
Al Al
Cl Cl Cl
19.(12分)氢气、纳米技术制成的金属燃料、非金属固体燃料已应用到社会生活和高科技领域。
⑴已知短周期金属元素A和B,其单质单位质量的燃烧热大,可用作燃料。其原子的第一至第四电离能如下表所示:
|
电离能(kJ/mol) |
I1 |
I2 |
I3 |
I4 |
|
A |
899.5 |
1757.1 |
14848.7 |
21006.6 |
|
B |
738 |
1451 |
7733 |
10540 |
①根据上述数据分析, B在周期表中位于 区,其最高价应为 ;
②若某同学将B原子的基态外围电子排布式写成了ns1np1,违反了 原理;
③B元素的第一电离能大于Al,原因是 ;
⑵氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由 。
②C60分子中每个碳原子只跟相邻的3个碳原子形成共价键,且每个碳原子最外层都满足8电子相对稳定结构,则C60分子中σ键与π键的数目之比为 。
18.(14分)有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度是同族元素所形成的氢化物中最大的;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A与D离子数之比为2∶1。请回答下列问题:
⑴A单质、B单质、化合物R的熔点大小顺序为下列的 (填序号):
①A单质>B单质>R; ②R>A单质>B单质;
③B单质>R >A单质; ④A单质>R>B单质。
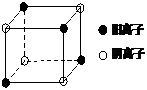 ⑵在CB3分子中C元素原子的原子轨道发生的是________杂化,其固体的晶体类型为
;
⑵在CB3分子中C元素原子的原子轨道发生的是________杂化,其固体的晶体类型为
;
⑶写出D原子的核外价电子排布式 _,C的氢化物比D的氢化物在水中溶解度大得多的可能原因
;
⑷右图是D和Fe形成的晶体FeD2最小单元“晶胞”,FeD2晶体
中阴、阳离子数之比为 ,FeD2物质中具有的化
学键类型为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com