
10.(1)向一密闭容器中充入1 mol A,2 mol B,发生如下反应:A(g)+2B(g) C(s)+3D(g),在一定条件下达到平衡,测得混合气体D的浓度为l.4 mol/L;
C(s)+3D(g),在一定条件下达到平衡,测得混合气体D的浓度为l.4 mol/L;
① 若压缩容器增大压强,则逆反应的速率 ;容器中D的浓度 ;(填“增大”、“减小”或“不变”)
② 温度升高,混合气体平均相对分子质量增大,则正反应 ;(填“吸热”或“放热”)
③ 在一体积可变的密闭容器中,充入0.8 mol C,3.5 mol D,若使D的浓度仍为l.4
mol/L,则容器体积取值范围为 。
(2)四种短周期元素A、B、C、D,它们原子的电子层数与最外层电子数之比分别为:
1:(1/3), 1:1 , 1:2 和 1:3 。据此回答下列问题:
① 仅根据上述信息就能够确定的元素是 A、D (选填A、B、C、D)。
② 在所有满足上述信息的短周期元素中,最高价氧化物的水化物酸性最强的是(填化学式)HSO ;由A、D两元素构成的化合物A2D2的电子式为(用元素符号填写,下同):Na+[:O:O:]2-Na+。
③ 写出所有的满足上述信息的化合物CD2与化合物A2D2反应的化学方程式:
_ 2NaO+2CO==2NaCO+O↑; SO+NaO==NaSO 。
④ 在满足上述信息的短周期元素中,若B2、CD和由B、C、D形成的化合物X的混合物 m g,在一定条件下与过量氧气充分反应后,将产物通过足量的固体A2D2,最终发现固体质量增重m g,则符合此条件的X的分子组成可用通式(CO)x·( H )y 来表示。
9.某无色溶液A中含有K+、Cl-、OH-、SO32-、SO42-,为检验确认其中所含的各阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞试液。检验其中OH- 的实验方法从略,检验其他阴离子的过程如下图所示。
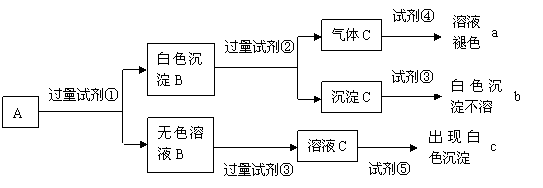
(1)图中试剂①-⑤溶质的化学式分别是:
① ,② ,③ ,④ ,⑤ 。
(2)图中现象a、b、c表明检验出的离子分别是:a 、b 、c 。
(3)白色沉淀B加试剂②反应的离子方程式是:
。
(4)无色溶液B加试剂③的主要目的是 。
(5)白色沉淀B若加试剂③而不加试剂②对实验的影响是
。
(6)无色溶液B加过量试剂③发生反应的离子方程式是:
。
8.将0.1 mol硫化氢气体缓慢通入100 mL 1 mol/L的NaOH溶液中(溶液的体积变化忽略不计),充分反应后,溶液中各微粒物质的量浓度关系错误的是( )
A、c(Na+) + c(H+)= 2c(S2-) + c(HS-) + c(OH-)
B、c(Na+) = c(HS-) + c(S2-)+ c(H2S)
C、c(OH-)+ c(S2-) = c(H2S) +c(H+)
D、c(Na+)> c(S2-) > c(OH-) > c(HS-) >c(H+)
7.镍-镉可充电电池,电极材料是Cd和NiO(OH),电解质是KOH,放电时的电极反应式是
Cd+2OH--2e-===Cd(OH)2,
2NiO(OH)+2H2O+2e-===2Ni(OH)2+2OH-
 下列说法不正确的是 ( )
下列说法不正确的是 ( )
A.电池的总反应式是Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2
B.电池充电时,镉元素被还原
C.电池放电时,电池负极周围溶液的pH不断增大
D.电池充电时,电池的负极和电源的负极连接
6.2005年诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的烯烃复分解催化剂。工业上冶炼钼的化学原理为
①2MoS2 + 7O2 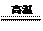 2MoO3 + 4SO2;
2MoO3 + 4SO2;
②MoO3 + 2NH3·H2O = (NH4)2MoO4 + H2O;
③(NH4)2MoO4 + 2HCl = H2MoO4↓+ 2NH4Cl;
④H2MoO4  MoO3 + H2O;
MoO3 + H2O;
⑤ 用还原剂将MoO3还原成金属钼。则下列说法正确的是( )DD D
A、 MoS2煅烧产生的尾气可直接排空
B、 MoO3是金属氧化物,也是碱性氧化物
C、 H2MoO4是一种强酸
D、 利用H2、CO和铝分别还原等量的MoO3,所消耗还原剂的物质的量之比为3:3:2
5. 对于平衡体系mA(g) + nB(g) pC(g) + qD(g);⊿H<0。 有下列判断,其中不正确的是( )
对于平衡体系mA(g) + nB(g) pC(g) + qD(g);⊿H<0。 有下列判断,其中不正确的是( )
A、若温度不变,将容器的体积增大为原来的两倍,此时A物质的浓度变为原来的0.48倍,则m + n < p + q
B、若平衡时A、B的转化率相等,说明反应开始时A、B的物的量之比为m : n
C、若容积不变升高温度,则达到新的平衡时D的体积分数增大
D、若平衡体系共有a mol气体,再向其中加入b molB,当达到新平衡时共有(a + b) mol气体,则m + n = p + q
4.下列有关物质结构的叙述,不正确的是( )
A.含离子键的化合物一定是离子化合物,熔融状态时能导电的晶体一定是离子晶体
B.分子晶体的熔沸点与共价键的强弱没有直接的关系
C.共价化合物中一定有极性共价键, 离子化合物中可能有极性共价键
D.含有非极性键的分子不一定是非极性分子
3.下列离子方程式书写正确的是( )
A、碳酸氢钙溶液中加入过量的氢氧化钠溶液:HCO3- + OH- ═ CO32- + H2O
B、氯化铁溶液中通入硫化氢气体:2Fe3+ + S2- ═ 2Fe2+ + S↓
C、次氯酸钙溶液中通入过量二氧化碳:Ca2+ + 2ClO- + H2O + CO2 ═ CaCO3↓+ 2HClO
D、氯化亚铁溶液中加入硝酸:3Fe2+ + 4H+ + NO3- ═ 3Fe3+ + 2H2O + NO↑
2.洗涤下列试管时,选用的试剂(括号内的物质)不妥的是( )
A、做过KMnO4分解实验的试管(浓盐酸)
B、做过木炭还原CuO的试管(硝酸)
C、做过银镜反应的试管(浓氨水)
D、做过Na2S2O3溶液与稀硫酸反应的试管(CS2)
1.生活中的问题常涉及化学知识,下列过程不涉及化学变化的是( )
A.用食醋或醋精除去暖瓶内的水垢 B.用四氯化碳擦去圆珠笔油渍
C.用糯米饭、酒曲等自制甜酒酿 D.用饱和食盐水自制消毒液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com