
6.若向量 、
、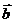 的夹角为
的夹角为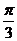 ,且
,且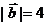 ,
,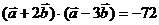 ,则
,则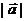 是
是
A.2 B.4 C.6 D.12
5.甲、乙两人各用篮球投篮一次,若两人投中的概率都是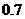 ,则恰有一人投中的概率是
,则恰有一人投中的概率是
A.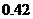 B.
B.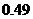 C.
C.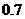 D.
D.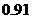
4.双曲线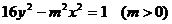 的一个顶点到它的一条渐近线的距离是
的一个顶点到它的一条渐近线的距离是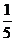 ,则
,则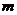 的值是
的值是
A.1 B.2 C.3 D.4
3.两正数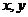 ,且
,且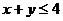 ,则点
,则点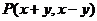 所在平面区域的面积是
所在平面区域的面积是
A.4 B.8 C.12 D.16
2.命题甲:若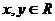 ,则
,则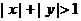 是
是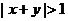 是充分而不必要条件;命题乙:函数
是充分而不必要条件;命题乙:函数 的定义域是
的定义域是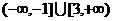 ,则
,则
A.“甲或乙”为假 B.“甲且乙” 为真
C.甲真乙假 D.甲假乙真
1.复数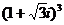 的值是
的值是
A.-8 B.8 C.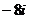 D.
D.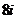
6. 膜技术原理在化工生产中有着广泛的应用。有人设想利用电化学原理制备少量硫酸和绿色硝化剂N2O5,装置图如下。
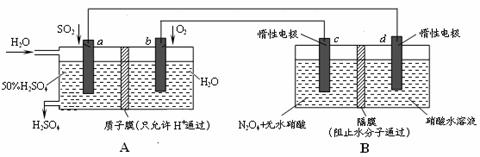
⑴A装置是________,B装置是_________(填“原电池”或“电解池”)。
⑵N2O5在电解池的______区生成,其电极反应式为_____________________________。
⑶通入O2一极的电极反应式为_______________________________。
⑷若通入SO2的速率为2.24 L·min-1(标准状况),为稳定持续生产,硫酸溶液的浓度应维持不变,则左侧水的流入速率应为_________mL·min-1。
5.
下图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“AsO43 -+2I-+2H+ AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液。
AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液。
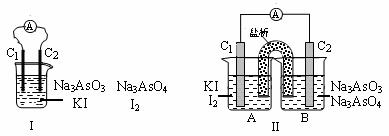
下列叙述中正确的是
A.甲组操作时,微安表(A)指针发生偏转
B.甲组操作时,溶液颜色变浅
C.乙组操作时,C2作正极
D.乙组操作时,C1上发生的电极反应为I2 +2e- 2I-
2I-
4. 下列四种装置中,溶液的体积均为250 mL,开始时电解质溶液的浓度均为0.10 mol·L-1,工作一段时间后,测得导线上均通过0.02 mol电子,若不考虑溶液体积的变化,则下列叙述正确的是
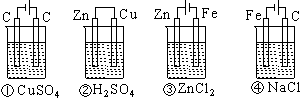
A.工作一段时间后溶液的浓度①=②=③=④
B.工作一段时间后溶液的pH:④>③>①>②
C.产生气体的总体积:④>③>①>②
D.电极上析出的固体的质量:①>②>③>④
3. 酸性高锰酸钾能将醇氧化生成一系列产物,反应中KMnO4被还原为Mn2+,用0.60 mol·L-1的酸性高锰酸钾溶液滴定20.0 mL0.50 mol·L-1的乙二醇溶液,当用去20.0 mL高锰酸钾溶液时,再滴加1滴高锰酸钾溶液时,溶液刚好呈紫色,振荡后不褪色。则乙二醇的氧化产物为
A.OHC-CHO B.HOOC-COOH C.HOOC-CHO D.CO2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com