
22. (12分)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
回答下列问题:
 (1)该反应的化学平衡常数表达式为K=
。
(1)该反应的化学平衡常数表达式为K=
。
 (2)该反应为
反应(选填“吸热”、“放热”)。
(2)该反应为
反应(选填“吸热”、“放热”)。
 (3)能判断该反应已经达到化学平衡状态的依据是
(多选扣分)。
(3)能判断该反应已经达到化学平衡状态的依据是
(多选扣分)。
 A、容器中压强不变;B、混合气体中c(CO)不变;C、v正(H2)=v逆(H2O);D、c(CO2)=c(CO)。
A、容器中压强不变;B、混合气体中c(CO)不变;C、v正(H2)=v逆(H2O);D、c(CO2)=c(CO)。
 (4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃
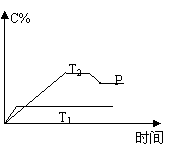
21.(12分)在一定条件下,可逆反应A + B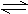 mC变化如右图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,P为反应在T2温度时达到平衡后向容器加压的变化情况,问:
mC变化如右图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,P为反应在T2温度时达到平衡后向容器加压的变化情况,问:
⑴温度T1 T2(填大于、等于或小于)
⑵正反应是 反应(填“吸热”或“放热”)
⑶如果A、B、C均为气体,则m 2(填大于、等于或小于)
⑷当温度和容积不变时,如在平衡体系中加入一定量的某稀有气体,
则体系的压强 (填增大、减小或不变),平衡 移动(填“向正反应方向”、“向逆反应方向”或“不”)。
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
20.(12分)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65KJ的热量。
(1)写出该反应的热化学方程式________________________________________________。
(2)已知H2O(l)== H2O(g);ΔH=+44 kJ·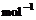 ,则16g液态水气化时,放出的热量是__________________KJ。
,则16g液态水气化时,放出的热量是__________________KJ。
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是________________________。
 (4)已知N2(g)+ 2O2(g)== 2NO2(g);ΔH=+67.7
kJ·
(4)已知N2(g)+ 2O2(g)== 2NO2(g);ΔH=+67.7
kJ·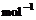 , N2H4(g)+ O2(g)== N2(g)+ 2H2O(g);ΔH=--534
kJ·
, N2H4(g)+ O2(g)== N2(g)+ 2H2O(g);ΔH=--534
kJ·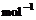 。根据盖斯定律写出肼与NO2完全反应的热化学方程式_______________________________________________。
。根据盖斯定律写出肼与NO2完全反应的热化学方程式_______________________________________________。
19.(12分)在一定条件下,xA + yB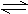 zC,达到平衡,试填写下列空白:
zC,达到平衡,试填写下列空白:
⑴若A、B、C都是气体,减压后向逆反应方向移动,则x、y、x之间的关系是 。
⑵已知C是气体,且x+y=z,加压时平衡如果发生移动,则平衡必向 方向移动,且A、B的状态中至少有一种是_____________________
⑶若B、C是气体,其他条件不变时增加A的用量,平衡不移动,则A的状态为 。
⑷加热后C的百分含量减少,则正反应是 反应(选填“吸热”、“放热”)
18.判断一个化学反应的自发性常用焓判据和熵判据,则在下列情况下,可以判定反应一定自发进行的是
A.ΔH>0,ΔS>0 B.ΔH<0,ΔS>0
C.ΔH>0,ΔS<0 D.ΔH<0,ΔS<0
第II卷 非选择题 (60分)
17.已知反应:PC15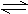 PC13 + C12,将1.0 mol PC15充入容积为2 L的密闭容器中,一段时间后,测得PC15的浓度为0.3 mol/L,在这段时间内的平均反应速率V(PC15)=0.4 mol/(L·min),则这段时间为
PC13 + C12,将1.0 mol PC15充入容积为2 L的密闭容器中,一段时间后,测得PC15的浓度为0.3 mol/L,在这段时间内的平均反应速率V(PC15)=0.4 mol/(L·min),则这段时间为
A、50 s B、30 s C、5 s D、1 s
16.一定条件下向一带活塞的密闭容器中充入2molSO2和1molO2,发生如下反应:
2SO2(g) +O2(g) 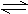 2SO3(g)达平衡后改变下列条件,SO3气体的平衡浓度不改变的是
2SO3(g)达平衡后改变下列条件,SO3气体的平衡浓度不改变的是
A、保持温度和容器内压强不变,充入1molSO3(g)
B、保持温度和容器内压强不变,充入1molAr(g)
C、保持温度和容器内压强不变,充入1molO2(g)
D、保持温度和容器的体积不变,充入1molSO2(g)
15、下列热化学方程式中的△H能表示物质燃烧热的是
A.2CO (g ) + O2 (g ) == 2CO2 (g ) ;△H = -556kJ·mol-1
B.CH4 (g ) + 2O2 (g ) == CO2 (g ) + 2H2O (l ) ;△H = -890kJ·mol-1
C.2H2 (g ) +O2 (g ) == 2H2O(l ) ;△H = -571.6kJ·mol-1
D.H2 (g ) + Cl2 (g ) == 2HCl (g) ;△H = -184.6kJ·mol-1
14、在一密闭容器中,反应aA(g)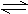 bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
A.物质A的转化率小了 B.平衡向正反应方向移动了
C.物质B的质量分数减小了 D.b>a
13、一定条件下,可逆反应N2 +3H2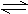 2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是
2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是
A、加催化剂,V正、V逆 都发生变化,且变化的倍数相等
B、加压,V正、V逆 都增大,且V正 增大的倍数等于V逆 增大的倍数
C、降温,V正、V逆 都减小,且V正 减小的倍数大于V逆 减小的倍数
D、增大氮气的浓度,V正、V逆 都增大,且V正 增大倍数大于V逆 增大倍数
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com