
12.Ⅰ.(6分)用序号填空:
(1)对以下课本中的各实验:
A.浓硫酸跟乙醇反应制乙烯 B.葡萄糖的银镜反应
C.乙酸乙酯的制取 D.石油的分馏
E.乙醛还原新制的氢氧化铜 F.中和热的测定
①需水浴加热的是: ;
②需要用温度计的是: 。
(2)下列对实验操作或实验事实的叙述正确的是
①用稀硝酸清洗做过银镜反应实验的试管
②配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌
③用碱式滴定管量取20.00 mL 0.1000 mol/L的KMnO4溶液
④用托盘天平称取10.50 g干燥的NaCl固体
⑤向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体
Ⅱ.(15分)已知乙醇的沸点是78℃,能与水以任意比例混溶。乙醚的沸点是34.6℃,微溶于水,在饱和Na2CO3溶液中几乎不溶,乙醚极易燃烧,今欲在实验室用乙醇制取乙醚。
(1)用化学方程式表示实验室制取乙醚的反应原理
,反应类型为 反应。
(2)甲和乙两位同学分别设计了如图两套实验室制取乙醚的装置,其中 装置更适合,理由是 。
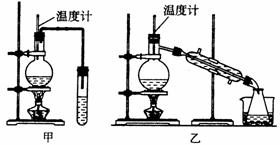
(3)反应时迅速升担到 ℃,然后保持温度,因此温度计应插入的位置是 。
(4)在装置乙的冷凝管中进、出水方向为 。用乙装置收集得到的乙醚中可能含的杂质是 ,除去这种杂质的试剂是 ,所用的主要仪器是 。
(5)如果温度过高将发生 反应(填反应类型)而生成副产物 。
11.(12分)A是一种可以作为药物的有机物。请根据下图所示的转化关系,回答问题。
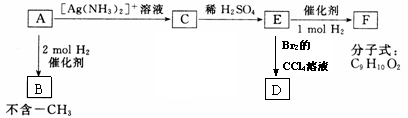
(1)写出A、B、F的结构简式:
A: B: F:
(2)写出下列变化的化学方程式,并注明反应类型。
A→C: ,反应类型 。
E→D: ,反应类型 。
(3)B的一种同分异构体只含一个―CH3,且1 mol该物质能与浓Br2水反应,共消耗3 mol
Br2。则该有机物的结构简简式为: 。
10.(13分)Ⅰ.下图为周期表中前四周期的表格:
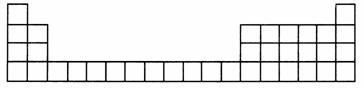
甲是中学课本中的化合物,其化学式为XCl3
(1)请根据课本中所见化合物;将X代表的元素符号,填在上面周期表格中对应的位置(只要求写出2种)。
(2)若一种XCl3晶体的熔点为-91℃,沸点为75℃,它属于 (填“原子”、“离子”、“分子”)晶体。
(3)若将一种XCl3水溶液蒸干、灼烧,得到红棕色粉末X2O3,则含碳的X合金在潮湿的空气中发生电化学腐蚀时,正极的电极反应式是 。
(4)若X代表另一种金属单质,该单质可与(3)中所述粉末发生转换反应,该反应化学方程式是 。
Ⅱ.A、B、C、D四种短周期元素,原子序数依次增大,离子半径依次减小,A与C可
形成原子个数比分别为l∶1和1∶2的两种离子化合物,A与D的原子序数之和等于B与C的原子序数之和,请回答下列问题:
(5)写出元素符号:B________,D________。
(6)1 mol C的氢氧化物与1 mol B单质在一定条件下恰好完全反应,生成一种盐、水及一种气体,写出该反应的化学方程式:________________________________。
(7)B、C形成的化合物溶于水时,溶液中所有离子的物质的量浓度由大到小的顺序为___________________________________________。
9.(14分)Ⅰ.ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2。已知反应物和生成物如下:ClO2,K2SO4,KClO3,H2C2O4,H2SO4,CO2,H2O。
(1)写出并配平以上化学反应方程式,标出电子转移的方向和数目:
(2)反应中 (填元素符号)被氧化, (填化学式)是还原产物。
(3)0.2 mo1 H2SO4 参与反应时有 mo1电子转移。
Ⅱ.蓄电池在放电时起原电池的作用,在充电时起电解池的作用。下式是爱迪生蓄电池分别在充电和放电时发生的反应:

Fe+NiO2+2H2O Fe(OH)2 + Ni(OH)2
(1)爱迪生蓄电池的电解质溶液是 (填“酸”或“碱”)溶液。
(2)放电时,正极反应式为 。
(3)充电时,电源的负极接在 极上(填物质的化学式),此电极反应式为
。
8. 在恒温恒容的密闭容器中,发生反应3A(g) + B(g)  xC(g)。
xC(g)。
Ⅰ. 将3 mol A和2 mol B在一定条件下反应,达平衡时C的体积分数为a。
Ⅱ. 若起始时A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a。下列说法正确的是
A.若Ⅰ达平衡时,混合气体与反应前相比平均分子量未发生变化,则x=3
B.若向Ⅰ平衡中再加入3 mol A和2 mol B,C的体积分数若大于a,可断定x>4
C.若x=2,则Ⅱ体系起始物质的量应当满足3n(B) = n(A)+ 3
D.若x=4,则Ⅱ体系起始物质的量应当满足3n(C)+8n(A)=10n(B)
Ⅱ卷(60分)
7. 拟从含FeCl3、FeCl2、CuCl2、HCl的废液中回收的Cu,用铜和石墨作电极进行电解,当观察到阴极上有少量气泡产生时,即停止电解。以下有关说法中正确的是
A. 阳离子的氧化性顺序为:Fe3+>Cu2+> Fe2+ > H+
B. 铜作阳极,电极反应为:Cu-2e―==Cu2+
C. 铜作阴极,电极上产生的气体是氢气
D. 若析出6.4 g Cu,则导线上转移的电子为0.1 mol
6. 在常温下在10 mL pH=10的KOH溶液中,加入pH=4的一元酸HA溶液至pH刚好等于7(假设反应前后溶液体积不变),则对反应后溶液有下列叙述:①c(A―)=c(K+) ②c(H+)=c(OH―)<c(K+)< c(A―) ③V酸≥10 mL ④V酸≤10 mL 其中正确的是
A.①③ B.①④ C.②③ D.②④
5. 下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他产物及反应所需条件均已略去),当X是强碱时,过量B跟C12除生成C外,另一产物是盐酸盐。
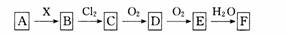
下列说法不正确的是
A.当X是强酸时,A、B、C、D、E、F均含同一种元素,F是H2SO4
B.当X是强碱时,A、B、C、D、E、F均含同一种元素,F是HNO3
C.B和C12的反应是氧化还原反应
D.当X是强酸时,C常温下是气态单质
4. 泰雅紫是古代地中海沿岸出产的一种贵重染料,罗马帝王用法律规定,只有皇族与教主可穿这种紫色衣袍。当时人们是从小的紫蜗牛中提取它的,制备15 g泰雅紫需要多达12 000只紫蜗牛,现知其结构为右图所示的含溴有机化合物。下列说法不正确的是
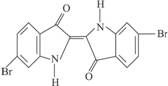
A.泰雅紫分子的分子式为:C16H8N2Br2O2
B.泰雅紫分子中所有原子不可能在同一平面上
C.泰雅紫能和酸反应可能与其结构中的氮原子有关
D.检验泰雅紫中溴元素可直接加入硝酸银溶液,看是否有浅黄色沉淀
3. 下列离子方程式书写正确的是
A.等物质的量浓度的FeI2溶液与溴水等体积混合:2I―+Br2 = I2+2Br―
B.NaHSO3溶液显弱酸性是因为:HSO3―+H2O = SO32―+H3O+
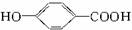
C. 尼泊金酸 与碳酸氢钠溶液反应:
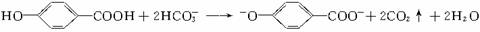
D.NaHSO4溶液与过量的Ba(OH)2反应:H+ + OH― = H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com