
28.(16分)
I.某校化学实验小组探究浓度对化学反应速率的影响,并测定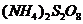 和KI反应的化学反应速率。进行如下实验探究:
和KI反应的化学反应速率。进行如下实验探究:
[实验原理]
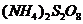 和KI反应的离子方程式为:
和KI反应的离子方程式为:
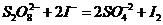 (1)
(1)
平均反应速率的计算式为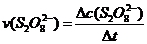 。
。
实验时,向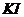 、
、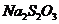 和淀粉指示剂混合溶液中加入
和淀粉指示剂混合溶液中加入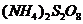 溶液,不断搅拌。
溶液,不断搅拌。
在反应(1)进行的同时,发生反应:
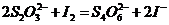 (2)
(2)
反应(1)生成的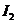 立即与
立即与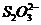 反应,生成无色的
反应,生成无色的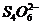 和
和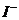 。
。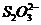 耗尽时,反应(1)继续生成的
耗尽时,反应(1)继续生成的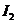 才与淀粉作用呈现蓝色。从加入
才与淀粉作用呈现蓝色。从加入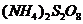 溶液到出现蓝色的时
溶液到出现蓝色的时
间为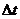 。
。
[实验内容]
(1)实验小组设计的实验记录表和数据记录如下,请将表中字母表示的空格填上。
|
实验编号 |
① |
② |
③ |
④ |
⑤ |
|
|
试剂 用量 (mL) |
0.20 mol·L (NH4)2S2O8
溶液 (NH4)2S2O8
溶液 |
20.0 |
10.0 |
b |
20.0 |
20.0 |
0.20
mol·L KI溶液 KI溶液 |
20.0 |
20.0 |
20.0 |
10.0 |
5.0 |
|
0.010
mol·L Na2S2O3溶液 Na2S2O3溶液 |
a |
8.0 |
8.0 |
8.0 |
8.0 |
|
|
0.2%淀粉溶液 |
2.0 |
2.0 |
2.0 |
2.0 |
2.0 |
|
0.20
mol·L KNO3溶液 KNO3溶液 |
0 |
0 |
0 |
10.0 |
c |
|
0.20
mol·L (NH4)2SO4 溶液 (NH4)2SO4 溶液 |
0 |
10.0 |
15.0 |
0 |
0 |
|
20℃时,反应时间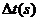 |
32 |
67 |
130 |
66 |
135 |
|
|
为了使溶液的离子强度和总体积保持不变,减少的(NH4)2S2O8溶液或KI溶液的用量,分别用(NH4)2SO4溶液或KNO3溶液补足;溶液混合后体积不变 |
(2)为了使反应充分进行,减少数据误差,实验过程中应该不断进行的操作是 。
(3)第①组实验的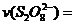 mol·(L·s)
mol·(L·s) 。
。
(4)根据上表数据分析,可以得到的结论有(写出一条即可) 。
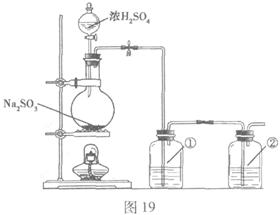 II.实验小组查资料得知,向含有NaCO3的Na2S溶液中通入SO2,可以制备上述实验所需的Na2S2O3。反应如下:
II.实验小组查资料得知,向含有NaCO3的Na2S溶液中通入SO2,可以制备上述实验所需的Na2S2O3。反应如下:
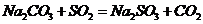
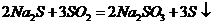

该小组根据上述原理设计如图19所示
装置制备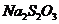 。
。
(1)实验应避免有害气体排放到空气中。
装置①、②中盛放的试剂依次是① ;
② 。
(2)实验过程中,随着气体的通入,装置①中有大量黄色固体析出,继续通入气体,可以观察到的现象是 。
(3)反应结束后,从制得的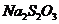 稀溶液中得到
稀溶液中得到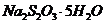 晶体的主要操作包括:
。
晶体的主要操作包括:
。
27.(14分)
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0-6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。
某科研小组用电浮选凝聚法处理污水,设计装置如图18所示:

(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的 。
a.H2SO4 b.BaSO4 c.N2SO4 d.NaOH e.CH3CH2OH
(2)电解池阳极的电极反应分别是① ;
②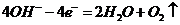 。
。
(3)电极反应①和②的生成物反应得到Fe(OH)3沉淀的离子方程式是 。
(4)熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。
已知负极的电极反应是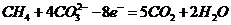 。
。
①正极的电极反应是 。
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此电池工作时必须有部分A物质参加循环。则A物质的化学式是 。
(5)实验过程中,若在阴极产生了44.8 L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况) L。
26.(12分)
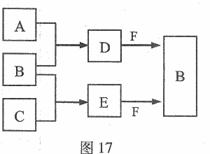 A、B、C是三种常见短周期元素的单质。常温下D为无色液体,E是一种常见的温室气体。其转化关系如图17 (反应条件和部分产物略去)。试回答:
A、B、C是三种常见短周期元素的单质。常温下D为无色液体,E是一种常见的温室气体。其转化关系如图17 (反应条件和部分产物略去)。试回答:
(1)E的电子式是 。
(2)单质X和B或D均能反应生成黑色固体Y,Y的化学式是 。
(3)物质Z常用于对空气进行杀菌、净化和水果保鲜等。Z和B的组成元素相同,Z分子中各原子最外层电子数之和为18。Z和酸性碘化钾溶液反应生成B和碘单质,反应的离子方程式是 。
(4)取0.3 mol F与足量D充分混合后,所得溶液中再通入0.2 mol E充分反应,最后得到的水溶液中各种离子的浓度由大到小的顺序是(不考虑H+) 。
(5)E的大量排放会引发很多环境问题。有科学家提出,用E和H2合成CH3OH和H2O,对E进行综合利用。25℃,101 kPa时,该反应的热化学方程式是 。(已知甲醇的燃烧热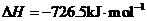 ,氢气的燃烧热
,氢气的燃烧热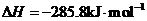 )
)
25.(16分)
有机物DBP常用作纤维素树脂和聚氯乙烯的增塑剂,特别适用于硝酸纤维素涂料。具有优良的溶解性、分散性和粘着性。由有机物A和邻二甲苯为原料可以合成DBP。
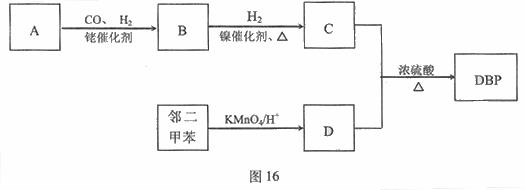
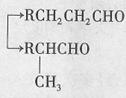
|
 已知:①RCH=CH2+CO+H2
已知:①RCH=CH2+CO+H2
②烃A是有机合成的重要原料。A的质谱图表明其相对分子质量为42,红外光谱表明分子中含有碳碳双键;B能发生银镜反应;有机物c的核磁共振氢谱显示其分子中含有5种氢原子,且其峰面积之比为3:2:2:2:1;DBP分子中苯环上的一溴取代物只有两种。
(1)A的结构简式是  。
。
(2)B含有的官能团名称是 。
(3)有机物C和D反应生成DBP的化学方程式是 。
(4)下列说法正确的是(选填序号字母) 。
a.A能发生聚合反应、加成反应和氧化反应
b.和C互为同分异构体,且含有相同官能团的有机物有2种
c.邻二甲苯能氧化生成D说明有机物分子中基团之间存在相互影响
d.1 mol DBP可与含2 mol NaOH的溶液完全反应
(5)工业上常用有机物E(C8H4O3)代替D生产DBP。反应分为两步进行:
①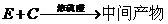 ②
②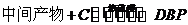
工业生产中在第②步中使用油水分离器将反应过程中生成的水不断从反应体系中分离除去,其目的是 。
(6)工业上生产有机物E的反应如下:
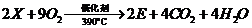
芳香烃X的一溴取代物只有两种,X的的结构简式是 。
24.(20分)
如图15所示,固定在上、下两层水平面上的平行金属导轨 、
、 和
和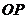 、
、 间距都是
间距都是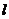 ,二者之间固定有两组竖直半圆形轨道
,二者之间固定有两组竖直半圆形轨道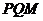 和
和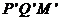 ,两轨道间距也均为
,两轨道间距也均为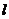 ,且
,且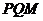 和
和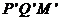 的竖直高度均为4R,两组半圆形轨道的半径均为R。轨道的
的竖直高度均为4R,两组半圆形轨道的半径均为R。轨道的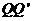 端、
端、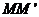 端的对接狭缝宽度可忽略不计,图中的虚线为绝缘材料制成的固定支架,能使导轨系统位置固定。将一质量为
端的对接狭缝宽度可忽略不计,图中的虚线为绝缘材料制成的固定支架,能使导轨系统位置固定。将一质量为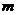 的金属杆沿垂直导轨方向放在下层导轨的最左端
的金属杆沿垂直导轨方向放在下层导轨的最左端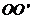 位置,金属杆在与水平成
位置,金属杆在与水平成 角斜向上的恒力作用下沿导轨运动,运动过程中金属杆始终与导轨垂直,且接触良好。当金属杆通过4R的距离运动到导轨末端
角斜向上的恒力作用下沿导轨运动,运动过程中金属杆始终与导轨垂直,且接触良好。当金属杆通过4R的距离运动到导轨末端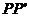 位置时其速度大小
位置时其速度大小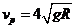 。金属杆和导轨的电阻、金属杆在半圆轨道和上层水平导轨上运动过程中所受的摩擦阻力,以及整个运动过程中所受空气阻力均可忽略不计。
。金属杆和导轨的电阻、金属杆在半圆轨道和上层水平导轨上运动过程中所受的摩擦阻力,以及整个运动过程中所受空气阻力均可忽略不计。
(1)已知金属杆与下层导轨间的动摩擦因数为 ,求金属杆所受恒力F的大小;
,求金属杆所受恒力F的大小;
(2)金属杆运动到 位置时撤去恒力F,金属杆将无碰撞地水平进入第一组半圆轨道
位置时撤去恒力F,金属杆将无碰撞地水平进入第一组半圆轨道 和
和 ,又在对接狭缝
,又在对接狭缝 和
和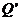 处无碰撞地水平进入第二组半圆形轨道
处无碰撞地水平进入第二组半圆形轨道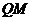 和
和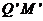 的内侧,求金属杆运动到半圆轨道的最高位置
的内侧,求金属杆运动到半圆轨道的最高位置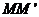 时,它对轨道作用力的大小;
时,它对轨道作用力的大小;
 (3)若上层水平导轨足够长,其右端连接的定值电阻阻值为
(3)若上层水平导轨足够长,其右端连接的定值电阻阻值为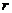 ,导轨处于磁感应强度为B、方向竖直向下的匀强磁场中。金属杆由第二组半圆轨道的最高位置
,导轨处于磁感应强度为B、方向竖直向下的匀强磁场中。金属杆由第二组半圆轨道的最高位置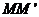 处,无碰撞地水平进入上层导轨后,能沿上层导轨滑行。求金属杆在上层导轨上滑行的最大距离。
处,无碰撞地水平进入上层导轨后,能沿上层导轨滑行。求金属杆在上层导轨上滑行的最大距离。
23.(18分)
示波管是示波器的核心部分,它主要由电子枪、偏转系统和荧光屏三部分组成,如图14甲所示。电子枪具有释放电子并使电子聚集成束以及加速的作用;偏转系统使电子束发生偏转;电子束打在荧光屏上形成光迹。这三部分均封装于真空玻璃壳中。已知电子的电荷量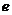 =1.6×10
=1.6×10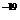 C,质量
C,质量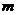 =0.91×10
=0.91×10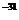 kg,电子所受重力及电子之间的相互作用力均可忽略不计,不考虑相对论效应。
kg,电子所受重力及电子之间的相互作用力均可忽略不计,不考虑相对论效应。
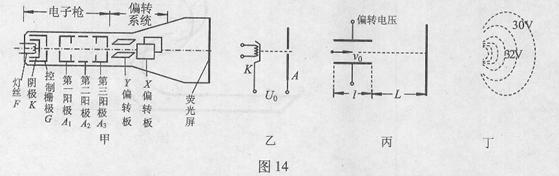
(1)电子枪的三级加速可简化为如图14乙所示的加速电场,若从阴极逸出电子的初速度可忽略不计,要使电子被加速后的动能达到16×10 J,求加速电压
J,求加速电压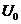 为多大;
为多大;
(2)电子被加速后进入偏转系统,若只考虑电子沿Y(竖直)方向的偏转情况,偏转系统可以简化为如图14丙所示的偏转电场。偏转电极的极板长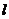 =4.0cm,两板间距离
=4.0cm,两板间距离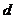 =1.0cm,极板右端与荧光屏的距离
=1.0cm,极板右端与荧光屏的距离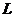 =18cm,当在偏转电极上加
=18cm,当在偏转电极上加 的正弦交变电压时,如果电子进入偏转电场的初速度
的正弦交变电压时,如果电子进入偏转电场的初速度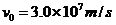 ,求电子打在荧光屏上产生亮线的最大长度;
,求电子打在荧光屏上产生亮线的最大长度;
(3)如图14甲所示,电子枪中灯丝用来加热阴极,使阴极发射电子。控制栅极的电势比阴极的电势低,调节阴极与控制栅极之间的电压,可控制通过栅极电子的数量。现要使打在荧光屏上电子的数量增加,应如何调节阴极与控制栅极之间的电压。电子枪中 、
、 和
和 三个阳极除了对电子加速外,还共同完成对电子的聚焦作用,其中聚焦电场可简化为如图14丁所示的电场,图中的虚线是该电场的等势线。请简要说明聚焦电场如何实现对电子的聚焦作用。
三个阳极除了对电子加速外,还共同完成对电子的聚焦作用,其中聚焦电场可简化为如图14丁所示的电场,图中的虚线是该电场的等势线。请简要说明聚焦电场如何实现对电子的聚焦作用。
22.(16分)
如图13所示,水上滑梯由斜槽AB和水平槽BC构成,AB与BC圆滑连接,斜槽的竖直高度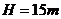 ,BC面高出水面的距离
,BC面高出水面的距离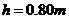 。一质量m=50kg的游戏者从滑梯顶端A
。一质量m=50kg的游戏者从滑梯顶端A 点由静止滑下,
点由静止滑下, 取10mol/s2。
取10mol/s2。
(1)若忽略游戏者下滑过程中受到的一切阻力,求游戏者从斜槽顶端A点由静止滑下到斜槽底端B点的速度大小;
(2)若由于阻力的作用,游戏者从滑梯顶端A点由静止滑下到达滑梯末端C点时的速度大小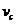 =15m/s,求这一过程中游戏者克服阻力做的功;
=15m/s,求这一过程中游戏者克服阻力做的功;
(3)若游戏者滑到滑梯末端C点以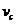 =15m/s的速度水平飞出,求他从C点水平飞出到落入水中时,他在空中运动过程中水平方向的位移。
=15m/s的速度水平飞出,求他从C点水平飞出到落入水中时,他在空中运动过程中水平方向的位移。

21.(18分)
(1)如图9所示为“验证碰撞中的动量守恒”的实
验装置。
①下列说法中不符合本实验要求的是
。(选填选项前面的字母)
A.入射球比靶球质量大或者小均可,但二者
的赢径必须相同
 B.在同一组实验的不同碰撞中,每次入射球
B.在同一组实验的不同碰撞中,每次入射球
必须从同一高度由静止释放
C.安装轨道时末端必须水平
D.需要的测量仪器有天平和刻度尺
②实验中记录了轨道末端在记录纸上的竖直
投影为O点,经多次释放入射球,在记录纸
上找到了两球的平均落点位置M、P、N,并
测得它们到O点的距离分别为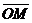 、
、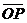
和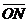 。已知入射球的质量为
。已知入射球的质量为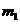 ,靶球的量
,靶球的量
为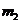 ,如果测得
,如果测得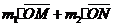 近似等
近似等
于 ,则可认为成功验证了碰撞中的
 动量守恒。
动量守恒。
(2)用一段长为80cm的金属丝做“测定金属的电
阻率”的实验。
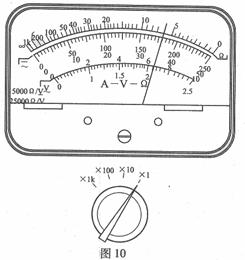
①用多用表粗测电阻丝的电阻,结果如图10
所示,由此可知电阻丝电阻的测量值约为
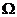 。
。
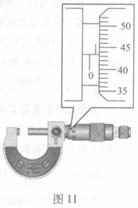
②用螺旋测微器测量金属丝的直径,结果如图
11所示,由此可知金属丝直径的测量结果为
mm。
③在用电压表和电流表测金属丝的电阻时,提供下列供选择的器材:
 A.直流电源(电动势约为4.5V,内阻很小)
A.直流电源(电动势约为4.5V,内阻很小)
B.电压表(量程0-3V,内阻约3k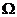 )
)
C.电压表(量程0-15V,内阻约15k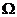 )
)
D.电流表(量程0-0.6A,内阻约0.125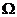 )
)
E.电流表(量程0-3A,内阻约0.025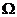 )
)
F.滑动变阻器(阻值范围0-15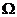 ,最大允许电流1A)
,最大允许电流1A)
G.滑动变阻器(阻值范围0-200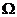 ,最大允许电流2A)
,最大允许电流2A)
H.开关、导线。
要求有较高的测量精度,并能测得多组数据,在供选择的器材中,电流表应选择 ,电压表应选择 ,滑动变阻器应选择 。(填字母代号)
,电压表应选择 ,滑动变阻器应选择 。(填字母代号)
④根据上面选择器材,完成图12中实验电路的连接。
20.如图8所示,在光滑的水平面上有一质量为M、倾角为 的光滑斜面
的光滑斜面
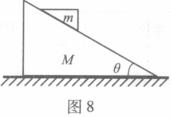 体,斜面上有一质量为m的物块沿斜面下滑。关于物块下滑过程中对斜面压力大小的解答,有如下四个表达式。要判断这四个表达式是否合理,你可以不必进行复杂的计算,而是根据所学的物理知识和物理方法进行分析,从而判断解的合理性或正确性。根据你的判断,下述表达式中可能正确的是 ( )
体,斜面上有一质量为m的物块沿斜面下滑。关于物块下滑过程中对斜面压力大小的解答,有如下四个表达式。要判断这四个表达式是否合理,你可以不必进行复杂的计算,而是根据所学的物理知识和物理方法进行分析,从而判断解的合理性或正确性。根据你的判断,下述表达式中可能正确的是 ( )
A.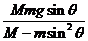 B.
B.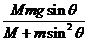
C.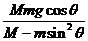 D.
D.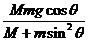
第Ⅱ卷(非选择题 共180分)
 本卷共11小题,共180分。
本卷共11小题,共180分。
19.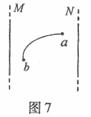 如图7所示,M、N为两条沿竖直方向放置的直导线,其中有一条导线中通有恒定电流,另一条导线中无电流。一带电粒子在M、N两条直导线所在平面内运动,曲线ab是该粒子的运动轨迹。带电粒子所受重力及空气阻力均可忽略不计。关于导线中的电流方向、粒子带电情况以及运动的方向,下列说法中可能正确的是 ( )
如图7所示,M、N为两条沿竖直方向放置的直导线,其中有一条导线中通有恒定电流,另一条导线中无电流。一带电粒子在M、N两条直导线所在平面内运动,曲线ab是该粒子的运动轨迹。带电粒子所受重力及空气阻力均可忽略不计。关于导线中的电流方向、粒子带电情况以及运动的方向,下列说法中可能正确的是 ( )
A.M中通有自上而下的恒定电流,带负电的粒子从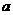 点向
点向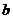 点运动
点运动
B.M中通有自上而下的恒定电流,带正电的粒子从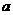 点向
点向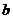 点运动
点运动
C.N中通有自上而下的恒定电流,带正电的粒子从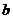 点向
点向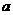 点运动
点运动
D.N中通有自下而上的恒定电流,带负电的粒子从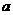 点向
点向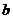 点运动
点运动
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com