
18.(10分)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。已知: §SO2(g) +1/2O2(g)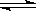 SO3(g) △H=-98 kJ·mol-1。
SO3(g) △H=-98 kJ·mol-1。
(1)某温度下该反应的平衡常数K=10/3,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时
 v(正) v(逆)(填“<”、“>”或“=”)。
v(正) v(逆)(填“<”、“>”或“=”)。
(2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 mol O2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为 。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是 (填字母)。
A.保持温度和容器体积不变,充入1.0 mol O2
B.保持温度和容器内压强不变,充入1.0 mol SO3
C.降低温度
D.移动活塞压缩气体
(4)若以右图所示装置,用电化学原理生产硫酸,写出通入O2电极的电极反应式为 。
(5)为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为
_______ _____。
17.(共8′)
现有浓度为0.1 mol·L-1的五种电解质溶液 ① Na2CO3、② NaHCO3、③ NaAlO2
④ CH3COONa、⑤NaOH。已知:CO2+3H2O+2AlO2-===2Al(OH)3↓+CO32-,试回答:
(1)这五种溶液的pH由大到小的顺序是
(用编号填写,下同);
(2)将五种溶液稀释相同的倍数时,其pH变化最大的是 ;
(3)在上述五种溶液中分别加入AlCl3溶液,能产生大量无色无味气体的是________;
(4)将上述①、②、③、④四种溶液两两混合时,有一对溶液相互间能发生反应,写出该反应的离子方程式 。
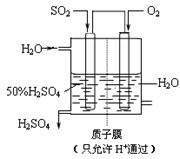
16.(14分)某化学研究性学习小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O。已知某化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。
部分阳离子以氢氧化物形式完全沉淀时的pH如下:
|
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Ni(OH)2 |
|
pH |
5.2 |
3.2 |
9.7 |
9.2 |
回答下列问题:
⑴ 操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为 。
⑵ “碱浸”过程中发生的离子方程式是 。
⑶“酸浸”时所加入的酸是 (填化学式)。酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是 。
⑷ 操作b为调节溶液的pH,你认为pH的最佳调控范围是 。
⑸“调pH为2~3”的目的是 。
⑹ 产品晶体中有时会混有少量绿矾(FeSO4·7H2O),其原因可能是 。
15.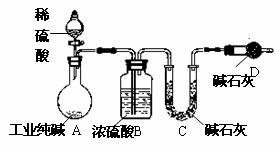 (10分)工业纯碱中常常含有NaCl、Na2SO4等杂质。为测定某工业纯碱的纯度,设计了如下图实验装置。
(10分)工业纯碱中常常含有NaCl、Na2SO4等杂质。为测定某工业纯碱的纯度,设计了如下图实验装置。
依据实验设计,请回答:
(1)装置中盛装稀硫酸的仪器名称是 ;
装置D的作用是
。
(2)为达到测定某工业纯碱的纯度实验目的,一次实验中至少应 进行称量操作的次数为 。
(3)若不考虑操作、药品及其用量等方面
的影响,该实验测得结果会 (填“偏高”、“偏低”、“无影响”);
原因是
(你若认为无影响,该空不用回答)。
14.常温下,下列各溶液的叙述中正确的是
 A.0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10mL混合后溶液显酸性
A.0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10mL混合后溶液显酸性
A (CH3COO-)>c (Cl-)>c (H+)>c (CH3COOH)
B.pH=7的醋酸钠和醋酸混合液中:c(Na+)= c(CH3COO-)
C.0.1mol/L的醋酸的pH=a,0.01mol/L的醋酸的pH=b,则a+1>b
D.已知酸性HF>CH3COOH,pH相等的NaF与CH3COOK溶液中,
[c(Na+)-c(F-)]< [c(K+)-c(CH3COO-)]
非选择题,共78分
13.下表为短周期元素①~⑧的部分性质。
|
元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|
原子半径/10-10m |
0.66 |
1.36 |
1.23 |
1.10 |
0.99 |
1.54 |
0.70 |
1.18 |
|
最高化合价 |
|
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
+3 |
|
最低化合价 |
-2 |
|
|
-3 |
-1 |
|
-3 |
|
下列说法正确的是 ( )
A.元素①⑧形成的化合物具有两性
B.元素⑦的气态氢化物稳定性比元素④的气态氢化物稳定性强
C.元素④⑤形成的化合物是离子化合物
D.上表8种元素中,元素③的最高价氧化物对应水化物的碱性最强
12.已知锰的核电荷数为25,以下是一些同学绘制的基态锰原子核外电子的轨道表示式(即电子排布图),其中最能准确表示基态锰原子核外电子运动状态的是
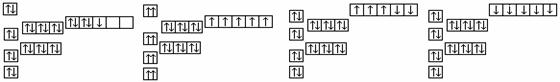
A. B. C. D.
11.用NA表示阿伏加德罗常数的值。下列说法正确的是 ( )
A.标准状况下,22.4L乙醇中含有的碳原子数目为2NApfue
B.1mol CnH2n含有的共用电子对数为(3n+1)NA
C.1mol CO2与1mol Na2O2完全反应时,转移的电子数目为NA
D.1mol/L的FeCl3溶液中,所含Fe3+的数目小于NA
10.下列离子方程式正确的是
A.用石墨电极电解氯化铝溶液:Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B.用氯气给自来水消毒:Cl2+H2O=2H++Cl-+ClO-
C.用Na2CO3溶液作洗涤剂:CO32- +H2O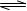 HCO3-+OH-
HCO3-+OH-
D.氮化镁加入过量稀盐酸中:Mg3N2 + 6H+ === 3Mg2+ + 2NH3↑
9.迷迭香酸是从蜂花属植物中提取到的酸性物质,其结构
如下图所示。下列叙述正确的是 ( )
A.迷迭香酸的分子式为C18H15O8
B.迷迭香酸可以发生加成、取代、显色反应
C.1mol迷迭香酸跟H2反应,最多消耗6molH2
D.1mol迷迭香酸与足量NaOH溶液反应,最多消耗6mol NaOH
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com