
4.关于作曲线运动的物体,以下说法正确的是
A.速度率一定发生改变 B.所受合外力一定不为零
C.速度方向与合外力方向有时就在一条直线上 D.合外力一定要做正功
3.下列说法正确的是
A.平均速度也就是速度的算术平均值 B.物体所受合力为零时,它一定处于静止状态
C.作用力与反作用力有时是不同性质的力 D.物体速度变化越快则加速度就越大
2.下列说法正确的是
A.物体从高处释放,物体在下落过程中不再受重力的作用
B.水面上的物体由于受浮力作用,重力将减小
C.物体间存在弹力作用则物体一定是相互接触的
D.当动摩擦因数一定时,物体所受的重力越大,它所受的滑动摩擦力也越大
1.下列四组物理量中全部属于矢量的是
A.力、位移、质量、时间 B.力、位移、速度、加速度
C.质点、质量、时间、时刻 D.时间、质量、功、功率
15已知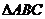 所在平面内一点
所在平面内一点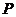 ,满足:
,满足: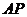 的中点为
的中点为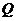 ,
,
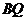 的中点为
的中点为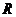 ,
,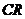 的中点为
的中点为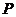 。设
。设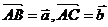 ,
,
如图,试用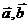 表示向量
表示向量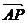 .
.
16已知关于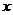 的方程
的方程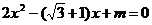 的两根为
的两根为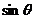 和
和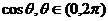 ,
,
(1)求实数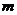 的值;
的值;
(2)求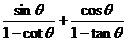 的值;(其中
的值;(其中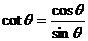 )
)
17四边形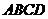 中,
中,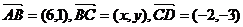
(1)若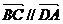 ,试求
,试求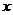 与
与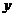 满足的关系式;
满足的关系式;
(2)满足(1)的同时又有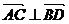 ,求
,求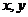 的值及四边形
的值及四边形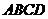 的面积。
的面积。
18某港口海水的深度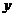 (米)是时间
(米)是时间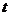 (时)(
(时)(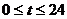 )的函数,记为:
)的函数,记为: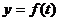
已知某日海水深度的数据如下:
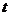 (时) (时) |
0 |
3 |
6 |
9 |
12 |
15 |
18 |
21 |
24 |
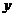 (米) (米) |
10.0 |
13.0 |
9.9 |
7.0 |
10.0 |
13.0 |
10.1 |
7.0 |
10.0 |
经长期观察,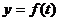 的曲线可近似地看成函数
的曲线可近似地看成函数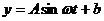 的图象
的图象
(1)试根据以上数据,求出函数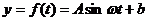 的振幅、最小正周期和表达式;
的振幅、最小正周期和表达式;
(2)一般情况下,船舶航行时,船底离海底的距离为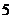 米或
米或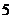 米以上时认为是安全的(船舶停靠时,船底只需不碰海底即可)。某船吃水深度(船底离水面的距离)为
米以上时认为是安全的(船舶停靠时,船底只需不碰海底即可)。某船吃水深度(船底离水面的距离)为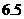 米,如果该船希望在同一天内安全进出港,请问,它至多能在港内停留多长时间(忽略进出港所需时间)?
米,如果该船希望在同一天内安全进出港,请问,它至多能在港内停留多长时间(忽略进出港所需时间)?
19已知向量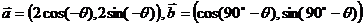
(1)求证: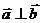 ;
;
(2)若存在不等于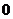 的实数
的实数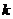 和
和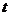 ,使
,使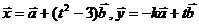 满足
满足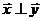 。试求此时
。试求此时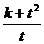 的最小值。
的最小值。
20.已知ΔABC的三个内角A、B.C满足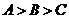 ,其中
,其中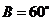 ,且
,且 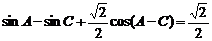 。
。
(1)求A、B.C的大小;
(2)求函数 在区间
在区间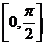 上的最大值与最小值
上的最大值与最小值
5.设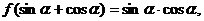 则
则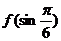 =_____________
=_____________
6若向量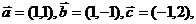 则
则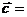 _________________(用
_________________(用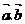 表示)
表示)
7函数 图象的对称轴方程是__________________
图象的对称轴方程是__________________
8已知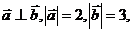 且
且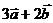 与
与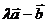 垂直,则实数
垂直,则实数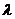 的值为________________
的值为________________
9函数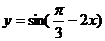 的单调递减区间是_____________________
的单调递减区间是_____________________
10有下列四种变换方式:
①向左平移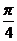 ,再将横坐标变为原来的
,再将横坐标变为原来的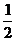 ; ②横坐标变为原来的
; ②横坐标变为原来的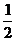 ,再向左平移
,再向左平移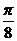 ;
;
③横坐标变为原来的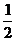 ,再向左平移
,再向左平移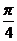 ;
④向左平移
;
④向左平移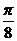 ,再将横坐标变为原来的
,再将横坐标变为原来的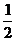 ;
;
其中能将正弦曲线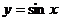 的图像变为
的图像变为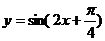 的图像的是______________
11
的图像的是______________
11 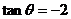 ,则
,则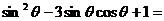
12已知点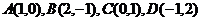 ,则
,则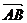 与
与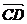 的夹角大小为______.
的夹角大小为______.
13已知正方形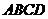 的边长为1,设
的边长为1,设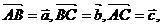 则
则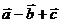 的模为 .
的模为 .
14函数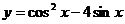 的值域是
的值域是
1化简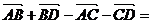 _________________
_________________
2 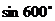 =_________________
=_________________
3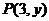 为
为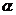 终边上一点,
终边上一点,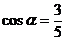 ,则
,则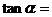 ______________
______________
4.已知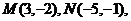 若
若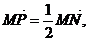 则
则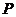 点的坐标为________________
点的坐标为________________
21.(11分)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2 + Na2CO3 == NaNO2 + NaNO3 + CO2↑ ①
NO + NO2 + Na2CO3 == 2NaNO2 + CO2↑ ②
⑴配制1000g质量分数为21.2%的纯碱吸收液,需Na2CO3·10H2O g;
⑵现有1000g质量分数为21.2%的纯碱吸收液,在20℃经充分吸收硝酸工业尾气后,测得吸收液中NaNO2和NaNO3物质的量之比为5:3(不考虑NO、 NO2与水的反应),
① 硝酸工业尾气中NO、 NO2的物质的量之比为 ;
② 若将反应后的溶液,蒸发掉688g水,冷却到0℃,最多可析出NaNO2多少克?(0℃时,NaNO2的溶解度为71.2g/100g水)
20.(15分)下表是元素周期表的一部分。
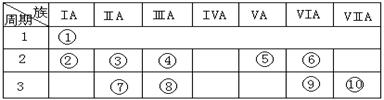
⑴下列说法正确且能说明元素⑩的非金属性比元素⑨强的是 。
A.同温同压下,元素⑩的气态氢化物溶解度大于元素⑨的气态氢化物
B.元素的最高价氧化物对应的水化物的酸性⑩强于⑨
C.元素⑨和⑩的单质与铁反应分别得到低价、高价铁的化合物
D.元素⑩的电负性大于元素⑨
⑵某元素原子的核外p电子数比s电子数少1,则该元素的元素符号是 ,与该元素单质分子互为等电子体的二价阴离子是 。
⑶已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质。写出元素③的氢氧化物与盐酸反应的离子方程式:
。
⑷上述元素⑦形成的晶体对应的晶胞为下图中的___________________(填写序号)。
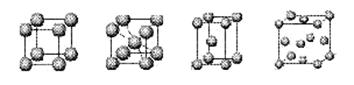
甲 乙 丙 丁
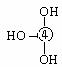 ⑸元素④的含氧酸的结构式可表示为 则可判断该酸为 酸(填强或弱)
⑸元素④的含氧酸的结构式可表示为 则可判断该酸为 酸(填强或弱)
一分子该酸与水作用,只能产生1个H+,请写出该酸溶于水后溶液显酸性的离子方程式 。
⑹已知元素⑧气态氯化物的化学式为R2Cl6,结构式如下,试并标出其中的配位键
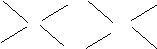 Cl
Cl
Cl
Cl
Cl
Cl
Al Al
Cl Cl Cl
19.(12分)氢气、纳米技术制成的金属燃料、非金属固体燃料已应用到社会生活和高科技领域。
⑴已知短周期金属元素A和B,其单质单位质量的燃烧热大,可用作燃料。其原子的第一至第四电离能如下表所示:
|
电离能(kJ/mol) |
I1 |
I2 |
I3 |
I4 |
|
A |
899.5 |
1757.1 |
14848.7 |
21006.6 |
|
B |
738 |
1451 |
7733 |
10540 |
①根据上述数据分析, B在周期表中位于 区,其最高价应为 ;
②若某同学将B原子的基态外围电子排布式写成了ns1np1,违反了 原理;
③B元素的第一电离能大于Al,原因是 ;
⑵氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由 。
②C60分子中每个碳原子只跟相邻的3个碳原子形成共价键,且每个碳原子最外层都满足8电子相对稳定结构,则C60分子中σ键与π键的数目之比为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com