
1、1828年德国化学家维勒从无机物制得了有机物,打破了只能从有机物取得有机物的学说,这种有机物是  ( )
( )
A.纤维素 B.树脂 C.橡胶 D.尿素
21. 氯化亚铜(CuCl)是重要的化工原料。国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.50%。工业上常通过下列反应制备CuCl
2CuSO4+Na2SO3+2NaCl+Na2CO3===2CuCl↓+3Na2SO4+CO2↑
⑴CuCl制备过程中需要配置质量分数为20.0%的CuSO4溶液,试计算配置该溶液所需的CuSO4·5H2O与H2O的质量之比。
⑵准确称取所配置的0.2500g CuCl样品置于一定量的0.5mol·L-1 FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol·L-1的Ce(SO4)2溶液滴定到终点,消耗24.60mLCe(SO4)2溶液。有关反化学反应为
Fe3++CuCl===Fe2++Cu2++Cl—
Ce4++Fe2+===Fe3++Ce3+
通过计算说明上述样品中CuCl的质量分数是否符合标准。
20.已知: 4NH3十5O2 → 4NO+6H2O
4NO十3O2十2H2O→4HNO3
设空气中氧气的体积分数为0.20,氮气体积分数为0.80,请完成下列填空及计算
(1)amolNO完全转化为HNO3需要氧气_______ mol
(2)为使NH3恰好完全氧化为一氧化氮,氨-空气混合物中氨的体积分数为________ (保
留2位小数)。
(3)20.0moL的NH3用空气氧化,产生混合物的组成为:NO18.0mol、O212.0 mol、N2150.0
mol和一定量的硝酸,以及其它成分。(高温下NO和O2不反应) 计算氨转化为NO
和HNO3的转化率。
(4) 20.0moL 的NH3和一定量空气充分反应后,再转化为HNO3
①在下图中画出HNO3的物质的量n(A)和空气的物质的量n(B)关系的理论曲线。
②写出当125≤n(B) ≤ 200时,n(A)和n(B)的关系式
_________________________________。

19.合成氨工业生产中所用的α—Fe催化剂的主要成分是FeO、Fe2O3
(1)某FeO、Fe2O3混合物中,铁、氧的物质的量之比为4︰5,其中Fe2+与Fe3+物质
的量之比为___________。
(2)当催化剂中Fe2+与Fe3+的物质的量之比为1︰2时,其催化活性最高,此时铁的氧
化物混合物中铁的质量分数为_____________(用小数表示,保留2位小数)。
 (3)以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:
(3)以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:
2 Fe2O3十C 4FeO十CO2↑。为制得这种活性最高的催化剂,应向480g Fe2O3
粉末中加入炭粉的质量为_________g。
18.钴(Co)化合物对化学键的研究起着重要的作用。为测定某钴化合物[Co(NH3)xCly]
Clz的组成,进行如下实验:
①称取样品0.5010g,加入过量的NaOH溶液,煮沸,蒸出所有的氨,冷却,得到A。
产生的氨用50.00mL0.5000mol·L-1的盐酸完全吸收并用蒸馏水定容至100mL,得溶液
B。取B溶液20.00mL, 用0.1000mol·L-1NaOH滴定,消耗NaOH溶液30.00mL。
②向A中加入过量KI固体,振荡,盐酸酸化后置于暗处,发生反应:Com++I-→Co2++I2 (未配平)
反应完成后,蒸馏水稀释,用Na2S2O3溶液滴定析出的I2,消耗0.1000mol·L-1Na2S2O3
溶液20.00mL。反应方程式为:I2+2Na2S2O3==2NaI+Na2S4O6
③另称取该物质样品0.2505g,溶于水,以0.1000mol·L-1AgNO3溶液滴定至恰好
反应完全,消耗AgNO3溶液20.00mL。相应反应式为:
[Co(NH3)xCly]Clz+zAgNO3==[Co(NH3)xCly](NO3)z+zAgCl↓
通过计算求:⑴[Co(NH3)xCly]Clz中氮元素的质量分数。
⑵该钴化合物的化学式。
17.地球化学中,通常用热重分析研究矿物在受热时的质量变化以确定其组成。取66.6mg由高岭石[Al4Si4O10(OH)8]和方解石(CaCO3)组成的矿物,加热,在673K-1123K区间内分解为氧化物,样品总失重13.8mg。
⑴方解石的失重百分比为 。
⑵计算矿物中高岭石的质量分数。
16.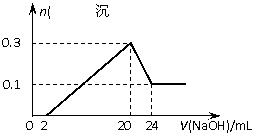 将一定质量的镁和铝的混合物投入100 mL盐酸中,固体全部溶解后,向所得溶液中
将一定质量的镁和铝的混合物投入100 mL盐酸中,固体全部溶解后,向所得溶液中
加入NaOH溶液,生成沉淀的物质的量与加入
NaOH溶液的体积关系如图所示。若不考虑金属
和盐酸反应时HCl的挥发,则下列说法正确的
是( )
A.镁和铝的总质量为9 g
B.盐酸的物质的量浓度为5 mol·L-1
C.NaOH溶液的物质的量浓度为5 mol·L-1
D.生成的氢气在标准状况下的体积为11.2 L
15.有 Na2CO3、NaHCO3、CaO 和 NaOH的混合物27.2 g, 把它们溶于足量水并充分反应后,
HCO3-、CO32-、Ca2+均转化为沉淀,将容器内水分蒸干后得到固体物质共29 g,则原混
合物中含Na2CO3 ( )
A.0.1 mol B.0.2 mol C.0.3mol D.无法确定
14.5 mL Ag+浓度为0.1 mol·L-1的某溶液,加入等物质的量的某种碱金属盐,待卤化物
完全沉淀后,经过滤、干燥,称得质量为0.013 g,则此沉淀是( )
A.LiF B.LiCl C.AgF D.AgCl
13.在天平两盘中各放一只大小和质量相同的烧杯,两烧杯中都盛有1 mol/L的稀硫酸100
mL,然后分别向两烧杯中加入一定质量的Mg与Al,充分反应后天平仍保持平衡,则Mg、
Al的质量分别是( )
A.2.4 g Mg 1.8 g Al B.5 g Mg 5 g Al
C.2 g Mg 2 g Al D.0.9697 g Mg 1 g Al
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com