
1.圆锥曲线在高考数学中占有十分重要的地位,是高考的重点、热点和难点.高考一般设计两个客观题和一个主观题,客观题考查直线与圆的关系和圆锥曲线的概念及基本几何性质,主观题一般通过以圆锥曲线为载体,与平面向量、导数、数列、不等式、平面几何等知识进行综合,结合数学思想方法,考查学生的数学思维能力及创新能力,其设问形式新颖、有趣、综合性很强.
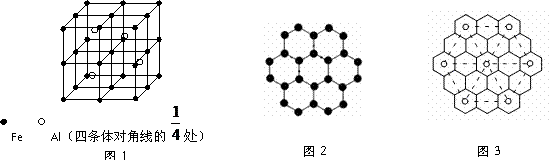
9. ⑴一种Al-Fe合金的立体晶胞如图1所示。确定该合金的化学式____________。用NA表示阿伏加德罗常数,则晶胞质量的计算式是_________________,若晶胞的边长=a nm,则此合金密度的计算式是________________g/cm3。
⑵石墨的层状结构如下图2所示,图中7个六元环实际占有的碳原子数是 ,若该层状结构可由很多个平行四边形无隙并置得到,每个平行四边形实际占有2个碳原子,请在图中画出一个这样的平行四边形。
⑶石墨能与熔融金属钾作用,形成蓝色的C24K、灰色的C48K、C60K等。有一种青铜色的CxK中K原子(用o表示)的分布如图3所示,则x= ;另有一种石墨化合物C32K,其中K原子的分布也类似图的正六边形,该正六边形的边长是上右图中正六边形边长的 倍。
7. 甲、乙、丙、丁为前三周期元素形成的微粒,它们的电子总数相等。已知甲、乙为双原子分子,丙为负二价双原子离子,丁为原子,丙、丁所含元素位于同主族且单质都是原子晶体。
⑴丁的电子排布式是______________________;⑵丙的电子式是_________________;
⑶乙在高温时是一种还原剂,请用化学方程式表示它在工业上的一种重要用途:
______________________________________________________________________
⑷甲分子中含有________个σ键和_________个π键。
⑸丁的氧化物晶体中,丁原子发生_________杂化,氧原子发生_________杂化。
6. 试用有关知识解释下列原因:
⑴有机物大多难溶于水,为什么乙醇和乙酸可与水互溶?________________。
⑵乙醚(C2H5OC2H5)的相对分子质量远大于乙醇,为什么乙醇的沸点比乙醚高得多?_________。
⑶从氨合成塔里分离H2、N2、NH3的混合物,采用什么方法?_____________;为什么用这种方法?__________。
⑷ 的沸点比
的沸点比 的沸点低,为什么?_______________。
的沸点低,为什么?_______________。
5.⑴某研究性学习小组为了探究SbCl3、SbCl5、SnCl4三种化合物的成键特点,做了如下实验,其中正确的是________________。
A.观察常温下的状态。SbCl5是苍黄色液体,SnCl4为无色液体。结论:SbCl5和SnCl4都是离子化合物
B.测定SbCl3、SbCl5、SnCl4的熔点依次为73.5℃、2.8 ℃、-33℃。结论:SbCl3、SbCl5、SnCl4都不是离子化合物
C.将SbCl3、SbCl5、SnCl4溶解于水中,滴入HNO3酸化的AgNO3溶液,产生白色沉淀。结论:SbCl3、SbCl5、SnCl4都是离子化合物
D.测定SbCl3、SbCl5、SnCl4的水溶液,发现它们都可以导电。结论:SbCl3、SbCl5、SnCl4都是离子化合物
⑵针对上述正确的实验结论,可判断SbCl3和SnCl4中Sb和Sn的杂化类型分别是________、_______。
⑶实验测得在极性溶剂中SbCl5的溶解度比SbCl3小很多,其主要原因是_______________________。
⑷实验测得同周期的Sb原子比Sn原子的第一电离能大很多,其主要原因______________________。
4. X+、Y+、M2+、N2-均为含有一定数目电子的短周期元素的简单离子,离子半径大小关系是:N2->Y+、Y+>X+、Y+>M2+,下列比较正确的是
A.原子半径:N可能比Y大,也可能比Y小 B.M2+、N2-核外电子数:可能相等,也可能不等
C.原子序数:N>M>X>Y D.碱性:M(OH)2>YOH
3. 下列分子中所有原子都满足最外层8电子结构的是
A.六氟化氙(XeF6) B.次氯酸(HClO) C.氯化硫(S2Cl2) D.三氟化硼(BF3)
2. 下列对HClO分子结构的描述,正确的是
A.O原子发生sp杂化 B.O原子与H、Cl都形成σ键
C.该分子为直线型分子 D.HClO分子的结构式是:H-Cl-O
1. 下列分子的比例模型中,中心原子上存在孤对电子的是
A. B.
B. C.
C. D.
D.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com