
2.Fe2+与Fe3+的鉴别
⑴直接观察颜色:Fe2+的溶液呈浅绿色,Fe3+的溶液呈棕黄色。
⑵利用显色反应:
① ,有关离子方程式:Fe3++SCN-==[Fe(SCN)]2+
,有关离子方程式:Fe3++SCN-==[Fe(SCN)]2+
②
⑶利用铁化合物沉淀的颜色:
①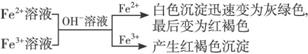
有关反应式:Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2+2H2O+O2=4Fe(OH)3。Fe3++3OH-==Fe(OH)3↓。
②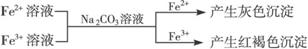
有关离子反应式:2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑
⑷利用Fe3+的氧化性:
①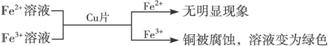 ,有关离子反应式:2Fe3++Cu==2Fe2++Cu2+
,有关离子反应式:2Fe3++Cu==2Fe2++Cu2+
②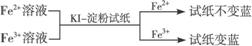 ,有关离子反应式:2Fe3++2I-==2Fe2++I2
,有关离子反应式:2Fe3++2I-==2Fe2++I2
③ ,有关离子反应式:Fe2++S2-==FeS↓,Fe3++S2-=2Fe2++S↓
,有关离子反应式:Fe2++S2-==FeS↓,Fe3++S2-=2Fe2++S↓
⑸利用Fe2+的还原性:
①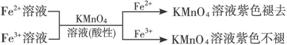 ,
,
有关离子反应式:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
②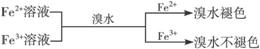 ,有关离子反应式:2Fe2++Br2==2Fe3++2Br-
,有关离子反应式:2Fe2++Br2==2Fe3++2Br-
注:以上方法以KSCN溶液鉴别最常用。
1.以铁、铜为中心的转化关系

2.铝三角之间的转换及其图像
在Al3+、Al(OH)3、AlO2-之间的相互转化反应中,都有特定的数量关系。其中的定量关系可用数学中数形结合的思想加以分析,现概括如下:
⑴在适量的可溶性铝盐溶液中逐滴加入NaOH溶液至过量:
现象:立即产生白色沉淀→渐多→最多(n(NaOH)∶n(Al3+)=3∶1)→渐少→消失(n(NaOH)∶n(Al3+)=4∶1),见下图⑴。
⑵在适量的偏铝酸盐溶液中逐滴加入稀盐酸至过量:
现象:立即产生白色沉淀→渐多→最多(n(H+)∶n(AlO2-)=1∶1)→渐少→消失(n(H+)∶n(AlO2-)=4∶1),见下图⑵。
⑶在适量的偏铝酸盐溶液中缓慢通入CO2至过量:现象:立即产生白色沉淀→渐多→最多(n(CO2)∶n(AlO2-)=1∶2)→沉淀不消失。见下图⑶。
⑷在适量强碱性溶液中逐滴加入铝盐溶液至过量:
现象:局部产生白色沉淀→振荡消失→白色沉淀→渐多→最多(n(OH)-∶n(Al3+)=(3∶1)→不消失。见下图⑷。
⑸在适量强酸性溶液中逐滴加入偏铝酸盐溶液至过量
现象:局部产生白色沉淀→振荡消失→白色沉淀→渐多→最多。见下图⑸。

1.
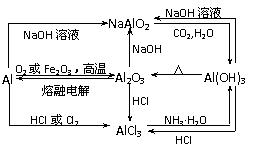 以Al2O3、MgCl2为中心的转化关系图
以Al2O3、MgCl2为中心的转化关系图
3.焰色反应
⑴概念:多种金属或它们的化合物在燃烧时使火焰呈特殊的颜色,这在化学上叫焰色反应,该反应属物理变化。
⑵用品:铂丝(或铁、铬、镍、钨等)、酒精灯(或煤气灯)、试剂。
⑶操作:进行焰色反应的操作,应把装在玻璃棒上的铂丝放在酒精灯火焰里灼烧,等到与原来火焰颜色相同的时候,蘸上要检验的溶液,放在火焰上观察火焰的颜色。观察钾的火焰颜色的时候,要透过蓝色的钴玻璃片去观察,这样可以滤去黄色的光,避免其中钠元素杂质所造成的干扰。
2.碱金属的性质规律与特例
⑴通常合金多呈固态,而钠钾合金却是液态。
⑵碱金属单质在空气或氧气中燃烧时,生成过氧化物甚至比过氧化物更复杂的氧化物,而Li只生成Li2O。
⑶碱金属单质密度一般随核电荷数增大而递增,但K的密度比Na小。
⑷碱金属单质一般跟水剧烈反应,但Li跟水反应缓慢(LiOH溶解度小)。
⑸碱金属单质因其活动性强,多保存在煤油中,而Li却因密度比煤油更小,只能保存在液体石蜡中。
⑹碱金属的盐一般都易溶于水,但Li2CO3却微溶。
⑺一般说,酸式盐较正盐溶解度大,但NaHCO3却比Na2CO3溶解度小。
⑻Fr是放射性元素,所以在自然界中不存在。
1.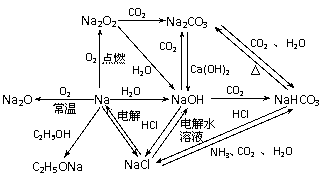 以Na为中心的转化关系图
以Na为中心的转化关系图
2.硅及其化合物的特殊性
⑴硅的还原性比碳强,而碳在高温下能从二氧化硅中还原出硅。
⑵非金属单质与强碱溶液反应一般不生成氢气,而硅与氢氧化钠等强碱溶液反应产生氢气。
⑶非金属单质一般不与非氧化性酸反应,而硅不但与氢氟酸反应,而且有氢气生成。
⑷酸性氧化物一般不与酸发生复分解反应,而二氧化硅却能与氢氟酸反应,生成四氟化硅和水。
⑸无机酸一般易溶于水,而硅酸和原硅酸却难溶于水。
⑹在水溶液中,碳酸的酸性比硅酸强,二氧化碳与硅酸钠反应生成碳酸钠和硅酸沉淀。在高温下碳酸钠与二氧化硅反应生成硅酸钠和二氧化碳,其原因是在高温条件下,生成的二氧化碳离开反应体系而使反应进行到底。
1. 以CO2为中心的转化关系图
以CO2为中心的转化关系图
3.关于硝酸化学性质的几个问题
⑴硝酸的还原产物可以为:NO2、NO、N2O、N2、NH3、NH4+等,HNO3的浓度越低,还原产物的价态越低。
⑵试管壁上的Cu或Ag应用稀硝酸洗去:用稀硝酸比用浓硝酸的HNO3利用率高,且产生的污染物(NOx)少。
⑶在化学反应过程中,因量变积累,常常引起反应实质的变化,除硝酸外,硫酸、盐酸其浓溶液、稀溶液的性质不同,反应过程中浓度变化也往往引起反应实质的变化,解题应给予充分注意。
⑷浓硝酸久置变黄,工业盐酸为黄色(含Fe3+)、亚铁盐放置溶液变黄(Fe2+被氧化为Fe3+)、KI溶液久置变黄(I-被氧化为I2),其中亚铁盐溶液中要加铁粉保存且现配现用。
⑸硝酸越浓,其氧化性越强,被还原的程度越小。硝酸的氧化性强弱不是根据硝酸被还原的产物的化合价改变的大小来决定,而是得电子难易程度决定。
⑹在单质与硝酸反应的有关计算中,要注意单质是金属还是非金属,若为金属参加的反应硝酸分为两部分,一部分作氧化剂,另一部分起酸性生成硝酸盐,应先确定未被还原的硝酸,再由电子得失守恒求解。若为非金属单质与硝酸反应时,硝酸全部被还原。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com