
5. 用标准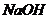 溶液滴定未知浓度的稀
溶液滴定未知浓度的稀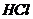 时,下列实验操作会引起测定结果偏小的是( )
时,下列实验操作会引起测定结果偏小的是( )
A. 滴定管滴定前有气泡,滴定终了无气泡
B. 锥形瓶用待测液润洗后再装待测液滴定
C. 读取碱液时滴定前仰视读数,滴定后俯视读数
D. 滴定管水洗后未用标准液润洗即装标准液进行滴定
4. 有关中和滴定实验操作不正确的是( )
A. 滴定过程中,左手振荡锥形瓶,右手控制开关
B. 滴定管中加进标准液后,要结合排放气泡操作,使液面降至零刻度以下
C. 锥形瓶用蒸馏水洗涤后,再用待测液润洗,再加进待测液
D. 滴定管用蒸馏水洗涤后,再用标准液润洗,再加进标准液
3. 有甲、乙、丙3瓶等体积、等物质的量浓度的硫酸。若将甲用水稀释,在乙中加入少量的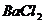 溶液,丙保持原状,然后用等浓度的
溶液,丙保持原状,然后用等浓度的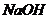 溶液滴定,至恰好完全反应时,所需
溶液滴定,至恰好完全反应时,所需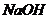 溶液的体积关系是( )
溶液的体积关系是( )
A.
丙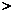 甲
甲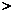 乙 B.
丙=甲
乙 B.
丙=甲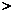 乙
乙
C.
乙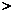 丙
丙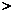 甲 D.
甲=乙=丙
甲 D.
甲=乙=丙
2. 有一支 酸式滴定管,其中盛有溶液,液面恰好在
酸式滴定管,其中盛有溶液,液面恰好在 刻度处。把滴定管中的溶液全部排出,承接在量筒中,量筒内溶液的体积( )
刻度处。把滴定管中的溶液全部排出,承接在量筒中,量筒内溶液的体积( )
A.
大于40.00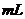 B. 为40.00
B. 为40.00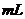
C.
小于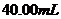 D.
为
D.
为
1. 某同学在实验报告中写有以下实验数据:① 用托盘天平称取11.7g食盐;② 用量筒量取5.26mL的盐酸;③ 用广泛pH试纸测得某酸溶液的pH值是3.3;④ 滴定盐酸时用去23.00mLNaOH溶液,其中数据合理的是( )
A. ①② B. ③④ C. ①④ D. ①③④
4. 中和热的测定:
(1)主要仪器:大烧杯、小烧杯、温度计、量筒、保温材料、环形搅拌棒。
(2)操作要点:量液、测温、混合、搅动、测温(最高温度)、计算。
[典型例题]
[例1] 要配制浓度约为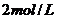 ,
,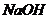 溶液
溶液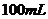 ,下面的操作正确的是( )
,下面的操作正确的是( )
A. 称取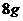
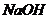 固体,放入
固体,放入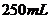 烧杯中,用
烧杯中,用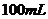 量筒量取
量筒量取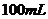 蒸馏水,加入烧杯中,同时不断搅拌至固体溶解
蒸馏水,加入烧杯中,同时不断搅拌至固体溶解
B. 称取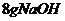 固体,放入
固体,放入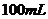 量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至
量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至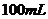
C. 称取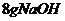 固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀
固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀
D. 用100mL量筒量取40mL5mol/L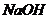 溶液,倒入
溶液,倒入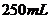 烧杯中,再用同一量筒取
烧杯中,再用同一量筒取 蒸馏水,不断搅拌下,慢慢倒入烧杯中
蒸馏水,不断搅拌下,慢慢倒入烧杯中
解析:本题考查对“配制一定物质的量浓度”要求的理解和量筒,容量瓶等计量仪器的使用,根据题目的数据和“约为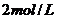 ”的要求可知,配制的精确度要求较低,所以可用水的体积代替溶液的体积;溶液与水混合时,可忽略体积的变化。因为
”的要求可知,配制的精确度要求较低,所以可用水的体积代替溶液的体积;溶液与水混合时,可忽略体积的变化。因为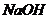 溶解时会放出大量的热,在量筒中直接溶解可能会使量筒炸裂;在容量瓶中直接溶解不仅会使容量瓶体积发生变化,也可能使容量瓶破裂。
溶解时会放出大量的热,在量筒中直接溶解可能会使量筒炸裂;在容量瓶中直接溶解不仅会使容量瓶体积发生变化,也可能使容量瓶破裂。
答案:AD
[例2] 用已知浓度的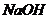 溶液测定某
溶液测定某 溶液的浓度,参考下图,从下表中选出正确选项( )
溶液的浓度,参考下图,从下表中选出正确选项( )
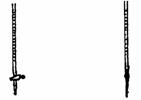
(甲) (乙)
|
|
锥形瓶中的溶液 |
滴定管中的溶液 |
选用指示剂 |
选用滴定管 |
|
A |
碱 |
酸 |
石蕊 |
(乙) |
|
B |
酸 |
碱 |
酚酞 |
(甲) |
|
C |
碱 |
酸 |
甲基橙 |
(甲) |
|
D |
酸 |
碱 |
酚酞 |
(乙) |
解析:本题考查中和滴定管中酸式滴定管和碱式滴定管和酸碱指示剂的选择。甲为酸式滴定管,乙为碱式滴定管,A、B选择错误,C、D选择正确。选择的指示剂最好是到达滴定终点时由浅变深发生变化,C、D符合要求。
答案:C、D
[例3] 回答中和热测定实验的有关问题:
(1)下图为测定装置,指出其中一处错误: 。
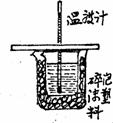
(2)下列做法可能会导致实验结果不准确的是 。
A. 大、小烧杯之间未填充任何物质
B. 使用稍过量的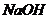 溶液
溶液
C. 用温度计测量盐酸温度后,不经处理就测量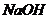 溶液的温度
溶液的温度
D. 向盐酸中缓缓加入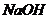 溶液
溶液
(3)若测得起始温度为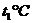 ,终止温度为
,终止温度为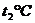 ,中和后生成溶液的比热容为
,中和后生成溶液的比热容为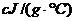 ,另知盐酸浓度为
,另知盐酸浓度为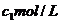 ,氢氧化钠溶液浓度为
,氢氧化钠溶液浓度为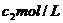 ,体积均为
,体积均为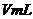 ,密度均认为是
,密度均认为是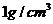 ,
,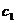 略小于
略小于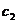 。则中和热为:
。则中和热为: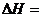
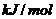 。
。
解析:该题主要考查中和热的装置,操作及数据处理。测定中和热的要点是测定热量数值必须稳定,准确,这就要求装置的保温性一定要好反应液热量均匀,反应充分。读数准确。 则(1)缺少环形搅拌器(2)中A、C、D均会造成热量测定不准确。A. 缺少保温层;D. 由于加入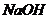 溶液慢,先加入的
溶液慢,先加入的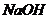 反应产生的热量易散失;C. 应将温度计冲洗后再测
反应产生的热量易散失;C. 应将温度计冲洗后再测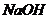 溶液的温度,因温度计表面的酸会和
溶液的温度,因温度计表面的酸会和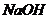 反应,使测定温度不准确。
反应,使测定温度不准确。
答案:
(1)缺环形玻璃搅拌器
(2)A、C、D
(3)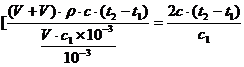 ,因是放热则
,因是放热则
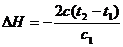
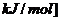
[模拟试题]
3. 酸、碱中和滴定:
(1)酸、碱中和滴定的原理。
(2)实验步骤:
① 滴定前的准备工作
② 滴定(一般重复2次,取平均值)
③ 计算
(3)实验仪器:滴定管(酸式、碱式各一支)、锥形瓶、滴定管夹、滴定台等。
(4)终点判断。
(5)误差分析。
2. 硫酸铜晶体结晶水含量的测定:
(1)实验原理:

(2)实验仪器:托盘天平、研钵、瓷坩埚、三脚架、泥三角、玻璃棒、干燥器、酒精灯。
(3)实验步骤:① 研磨;② 称量;③ 加热;④ 称量;⑤ 再加热、再称量至恒重;⑥ 计算。
(4)注意事项:
① 晶体加热后应放入干燥器内冷却。
② 晶体加热应摊开尽量使之受热均匀。
③ 加热时间不能过长,温度不能过高。
(5)误差分析
1. 配制一定物质的量浓度的溶液。
(1)实验仪器:烧杯、玻璃棒、容量瓶、胶头滴管、药匙、托盘天平(溶质为固体时使用)、量筒(浓溶液稀释时使用)
(2)实验步骤
① 计算;② 称量(或量取);③ 溶解(或初步稀释);④ 转移;⑤ 定容;⑥ 摇匀。(一般需二次,一次在④,⑤之间,一次在定容后)。
(3)注意事项:
① 必须在溶解后冷却至室温再转移到容量瓶中。
② 转移时要小心引流,不得将液体洒到容量瓶外。
③ 易水解的强酸弱碱盐应加少量的酸。易氧化物质应在使用前配制。
(4)误差分析
化学实验(四)重要的定量实验及实验检测
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com