
14.下列各组离子一定能大量共存的是
A.能与金属铝反应放出氢气的溶液:K+、NO3-、Cl-、NH4+
B.常温下水电离出的c(H+)·c(OH-)=10-20的溶液中:Na+、C1-、S2-、SO32-
C.在强碱溶液中:Na+、K+、AlO2-、CO32-
D.在pH=1的溶液中:K+、Fe2+、Cl-、NO3-
13.常温时,将两种溶液等体积混合,其中溶液pH一定或可能等于7的情况共有
①pH=2盐酸和pH=12 NaOH溶液 ②pH=2醋酸和pH=12 NaOH溶液
③pH=2盐酸和pH=12氨水 ④pH=2某酸和pH=12 NaOH溶液
⑤pH=2盐酸和pH=12某碱溶液 ⑥pH=2硫酸和pH=12 NaOH溶液
⑦pH=2盐酸和pH=12 Ba(OH)2溶液 ⑧pH=2硫酸和pH=12 Ba(OH)2溶液
A.5种 B.6种 C.7种 D.8种
12.取五等份NO2 ,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:
2NO2(g) N2O4(g),ΔH<0 反应相同时间后,分别测定体系中N2O4的百分量(N2O4%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果
N2O4(g),ΔH<0 反应相同时间后,分别测定体系中N2O4的百分量(N2O4%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果
相符的是
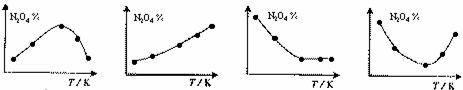
A B C D
11. 甲醇广泛用作燃料电池的燃料,可用天然气来合成,已知:
①2CH4(g)+O2(g)=2CO(g)+4H2(g);ΔH=-71 kJ·mol-1
②CO(g)+2H2(g)=CH3OH(l);ΔH=-90.5 kJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(l);ΔH=-890 kJ·mol-1
下列说法不能得出的结论是
A.反应②在任何温度下均能自发进行
B.CO(g)+2H2(g)=CH3OH(g) ΔH>-90.5 mol·L-1
C.甲醇的燃烧热ΔH=-764 kJ·mol-1
D.若CO燃烧热ΔH=-282.5 kJ·mol-1,则H2燃烧热ΔH=-286 kJ·mol-1
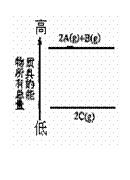
10.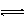 对于可逆反应:2A(g)+B(g) 2C(g) △H<0,下列各图中正确的是
对于可逆反应:2A(g)+B(g) 2C(g) △H<0,下列各图中正确的是
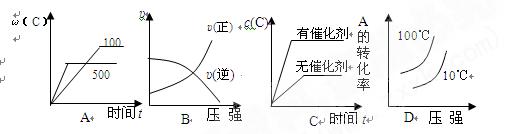
9、下列说法正确的是
①用25mL酸式滴定管可以准确放出8.00mL的稀盐酸;
②可用干燥的pH试纸测定氯水的pH;
③使用容量瓶配制溶液,定容时俯视,所得溶液的浓度偏大;
④加入盐酸有能使澄清石灰水变浑浊的无色气体生成,则原溶液中一定有大量CO 存在;
存在;
⑤在某温度下,一定量的醋酸与氢氧化钠溶液充分混合,若溶液呈碱性时,溶液中离子浓度大小的关系一定为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
 ⑥右图是反应物和生成物的能量变化示意图,其可能发生反应的热化学方程式可表示为:2A(g)+B(g)
2C(g);
△H=QkJ·mol-1(Q<0)。
⑥右图是反应物和生成物的能量变化示意图,其可能发生反应的热化学方程式可表示为:2A(g)+B(g)
2C(g);
△H=QkJ·mol-1(Q<0)。
A.①③④ B.②④⑤ C.①③⑥ D.③⑤⑥
8.在某温度下,向容积为2 L的密闭容器中通入0.1mol SO3, 当反应器中的气体压强不再变化时测得SO3转化率为20%,则该温度下反应2SO2
(g)+O2(g)
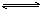 2SO3(g) 的化学平衡常数为
2SO3(g) 的化学平衡常数为
 A.3.2×103
B.1.6×103
C.8.0×102
D.4.0×103
A.3.2×103
B.1.6×103
C.8.0×102
D.4.0×103
7、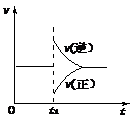 可逆反应2SO2(g)+O2(g) 2SO3(g) △H<0在一定条件下达到平衡状态,时间为t1时改变条件。化学反应速率与反应时间关系如图。下列说法中正确的是
可逆反应2SO2(g)+O2(g) 2SO3(g) △H<0在一定条件下达到平衡状态,时间为t1时改变条件。化学反应速率与反应时间关系如图。下列说法中正确的是
A.维持温度、反应体系体积不变,t1时充入SO3(g)
B.维持压强不变,t1时升高反应体系温度
C.维持温度不变,t1时扩大反应体系体积
D.维持温度、压强不变,t1时充入SO3(g)
6、已知甲、乙、丙、丁四种溶液分别为AlCl3、NH3·H2O、CH3COOH、NaCl中的一种,相同温度下,甲和乙两溶液的pH相同, 甲和丙中水的电离程度相同,则丙是
A.CH3COOH B.AlCl3 C. NH3·H2O D.NaCl
5、稀释0.1 mol / L的醋酸溶液,其中随水的增加而增大的有
⑴H+的物质的量 ⑵ c(H+ ) ⑶ c(OH- ) ⑷ c(H+ ) / c(CH3COOH) ⑸ c(CH3COOH) / c(CH3COO- )
A. ⑴ ⑶ ⑷ B. ⑴ ⑶ ⑸ C. ⑵ ⑷ ⑸ D. ⑵ ⑶ ⑸
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com