
24.(12分)830K时,在密闭容器中发生下列可逆反应:
CO(g)+H2O(g) CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0
试回答下列问题:
(1)若起始时c(CO)=2 mol·L-1,c(H2O)=3 mol·L-1,4秒钟后达到平衡,此时CO的转化率为60%,则在该温度下,该反应的平衡常数K= .
用H2O表示的化学反应速率为 。
(2)在相同温度下,若起始时c(CO)=1 mol·L-1,c(H2O)=2 mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态 (填“是”与“否”),此时v(正) v(逆)(填“大于”“小于”或“等于”)。
(3)若降低温度,该反应的K值将 ,该反应的化学反应速率将
(均填“增大”“减小”或“不变”)。
23.(10分)⑴北京奥运会祥云火炬将中国传
 统文化、奥运精神以及现代高科技融为一
统文化、奥运精神以及现代高科技融为一
体。火炬内熊熊大火来源于丙烷的燃烧,丙
烷是一种优良的燃料。试回答下列问题:
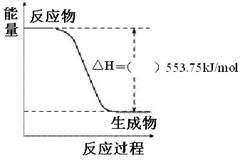
① 右图是一定量丙烷完全燃烧生成
CO2和1mol H2O(l)过程中的能量变化图,请在附图中的括号内填入“+”或“-”。
② 写出表示丙烷燃烧热的热化学方程式:
_______ _____________________。
③二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1mol二甲醚完全燃烧生成CO2和液态水放出1455kJ热量。若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1645kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为_____ __。
⑵盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
①已知: H2O(g)=H2O (l) △H1=-Q1 kJ/mol
C2H5OH(g)=C2H5OH (l) △H2=-Q2 kJ/mol
C2H5OH (g)+3O2(g)=2CO2(g)+3H2O(g) △H3=-Q3 kJ/mol
若使23g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为____________kJ。
②碳(s)在氧气供应不充分时,生成CO同时还部分生成CO2,因此无法通过实验直接测得反应:C(s)+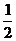 O2(g)
O2(g) CO(g)的△H。但可设计实验、利用盖斯定律计算出该反应的△H,计算时需要测得的实验数据有 。
CO(g)的△H。但可设计实验、利用盖斯定律计算出该反应的△H,计算时需要测得的实验数据有 。
22.(16分)物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识的回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为 。
(2)B为0.1 mol·L-1NaHCO3溶液,实验测得NaHCO3溶液的pH > 7,请分析NaHCO3溶液显碱性的原因: 。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入 ,目的是 ;
把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为 。
(4)D是物质的量浓度相同的醋酸和氢氧化钠混合而成的溶液,溶液中醋酸根离子和钠离子浓度相等,则D溶液呈 性。混合过程中醋酸溶液的体积 氢氧化钠溶液体积(填大于、小于或等于)。
(5)E为含有足量AgCl固体的饱和溶液,氯化银在水中存在沉淀溶解平衡:
 AgCl(S) Ag+(aq)+
Cl-(aq) 在25℃时,氯化银的Ksp
= 1.8×10-10
AgCl(S) Ag+(aq)+
Cl-(aq) 在25℃时,氯化银的Ksp
= 1.8×10-10
25℃时,现将足量氯化银分别放入:①100mL蒸馏水中;②100mL 0.2 mol·L-1AgNO3溶液中;③100mL 0.1 mol·L-1氯化铝溶液中;④100mL 0.1 mol·L-1盐酸溶液中。充分搅抖后,相同温度下银离子浓度由大到小的顺序是 (填写序号);②中氯离子的浓度为 mol·L-1。
21.(12分)现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_____热反应,且m+n_____p(填“>”“=”“<”)。
(2)若加入B(保持体系体积不变),则A的转化率_________,B的转化率_________。(填“增大”“减小”或“不变”,下同)
(3)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色_______,而维持容器内压强不变,充入氖气时,混合物颜色_______(填“变深”“变浅”或“不变”)。
20.25℃时,水的电离达到平衡:H2O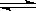 H++OH-;ΔH>0,下列叙述正确的是
H++OH-;ΔH>0,下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH―)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,pH不变
19.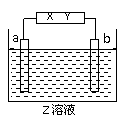 有一电解池中X,Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的是( )
有一电解池中X,Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的是( )
|
组合 |
a极板 |
b极板 |
X电极 |
Z溶液 |
|
A |
锌 |
石墨 |
负极 |
CuSO4 |
|
B |
石墨 |
石墨 |
负极 |
NaOH |
|
C |
银 |
铁 |
正极 |
AgNO3 |
|
D |
铜 |
石墨 |
负极 |
CuCl2 |
18. 下列叙述正确的是
A.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)>c(NO3-)
B.常温下,同浓度的Na2S与NaHS溶液相比,NaHS溶液的pH大
C.等物质的量浓度的NH4Cl溶液和NH4HSO4溶液,后者的c(NH4+)大
D.能使红色石蕊变蓝的溶液中,Na+、S2-、Br-、NH4+等离子可以大量共存
17.工业上合成氨反应的能量变化如图所示,该反应的热化学方程式是
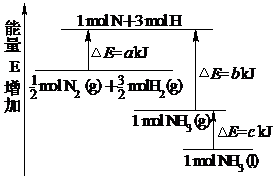 A.N2(g)+3H2(g)=2NH3(l);
A.N2(g)+3H2(g)=2NH3(l);
ΔH=2(a-b-c) kJ·mol-1
B.N2(g)+3H2(g)=2NH3(g);
ΔH=2(b-a) kJ·mol-1
C.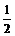 N2(g)+
N2(g)+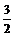 H2(g)=NH3(l);
H2(g)=NH3(l);
ΔH=(b+c-a) kJ·mol-1
D.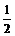 N2(g)+
N2(g)+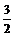 H2((g)=NH3(g);
H2((g)=NH3(g);
ΔH=(a+b) kJ·mol-1
16. 用已知浓度的盐酸滴定未知浓度的NaOH溶液,选用酚酞作指示剂,下列操作会导致测定结果偏低的是
A.酸式滴定管未润洗就装标准液滴定
B.锥形瓶未用待测液润洗
C.读取标准液读数时,滴前仰视,滴定到终点后俯视
D.滴定前酸式滴定管尖嘴处有气泡未排除,滴定后气泡消失
15.合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:
N2(g)+3H2(g)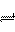 2NH3(g),673K,30Mpa
2NH3(g),673K,30Mpa
下n(NH3)和n(H2)随时间变化的关系如下图
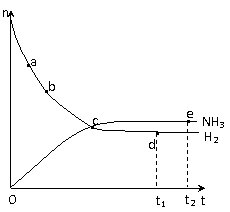 所示。下列叙述正确的是
所示。下列叙述正确的是
A.点a的正反应速率比点b的小
B.点 c处反应达到平衡
C.点d (t1时刻) 和点 e (t2时刻) 处
n(N2)不一样
D.其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com