
27(8分)A、B、C、D、E五种元素的原子序数依次增大,且均小于18;A原子的最外层比B原子的最外层少2个电子,A原子的最外层电子数是次外层电子数的两倍;A、B、C三种元素能结合成化合物C2AB3,在1 mol C2AB3中共有52mol电子,D元素的单质0.5mol与酸全部反应时,有9.03×1023个电子转移,在B与D形成的化合物,D的质量分数为52.94%,D原子核内有14个中子,每个E原子与氢原子化合时只生成了一个共价单键。试填写下列空白
(1)这五种元素的名称A B C D E
(2)C在B中燃烧生成的化合物中化学键有 键和 键(填离 子、极性、非极性)
(3)A、B、C结合成的化合物的化学式是
|
20(3分)已知:2Al
(s)+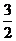 O2(g)=== Al2O3(s) △H= -1
644.3 kJ• mol-1
O2(g)=== Al2O3(s) △H= -1
644.3 kJ• mol-1
2Fe (s) +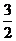 O2(g)=== Fe2O3(s) △H=
-815.88 kJ• mol-1
O2(g)=== Fe2O3(s) △H=
-815.88 kJ• mol-1
试写出铝粉与氧化铁粉末发生铝热反应的热化学方程式 。
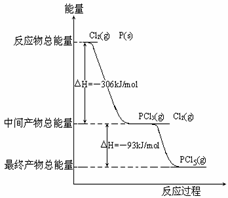 21(6分)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
21(6分)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式_________________________________。
(2)PCl5分解成PCl3和Cl2的热化学方程式_________________________________
(3)P和Cl2分两步反应生成1molPCl5的△H3=_________,P和Cl2一步反应生成1molPCl5的△H4______△H3(填“大于”、“小于”或“等于”)
22(8分)下图为氢氧燃料电池原理示意图,请根据提示写出正负极的电极反应式
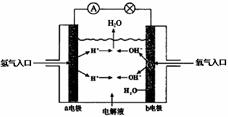
(1) 以硫酸为电解液:
负极:
正极:
(2) 以氢氧化钾为电解液:
负极:
正极:
23(7分)用A+、B-、C2-、D、E、F、G和H分别表示含有18个电子八种微粒(离子或分子)。请回答:⑴A元素是 、B元素是 、C元素是 (用元素符号表示)。
⑵D是由两种元素组成的双原子分子,其分子式是 。
⑶E是所有含18个电子的微粒中氧化能力最强的分子,其分子式是 。
⑷F是由两种元素组成的三原子分子,其分子式是 。
⑸G分子中含有4个原子,其分子式是 。
24(8分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用具体的元素符号回答下列问题:

(1)④、⑤、⑥的原子半径由大到小的顺序为_________________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_________________________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)_________________。
a.MnO2 b.Na2SO3 c.KMnO4
25(4分)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。
锌片上发生的电极反应: ;
银片上发生的电极反应: 。
26(7分)、依据氧化还原反应:2Ag+(aq) + Cu(s) == Cu2+(aq) + 2Ag(s)设计的原电池如图所示。
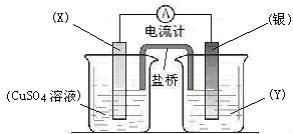
请回答下列问题:
(1)电极X的材料是 ;电解质溶液Y是 ;
(2)银电极为电池的 极,发生的电极反应为 ;
X电极上发生的电极反应为 ;
(3)外电路中的电子是从 电极流向 电极。
19、元素X、Y和Z可结合形成化合物XYZ3;X、Y和Z的原子序数之和为26;Y和Z在同一周期。下列有关推测正确的是
A.XYZ3是一种可溶于水的酸,且X与Y可形成共价化合物XY
B.XYZ3是一种微溶于水的盐,且X与Z可形成离子化合物XZ
C.XYZ3是一种易溶于水的盐,且Y与Z可形成离子化合物YZ
D.XYZ3是一种离子化合物,且Y与Z可形成离子化合物YZ3
Ⅱ卷(共51分)
18、W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比为7:17;X与W同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反应为黄色。下列判断正确的是
A.金属性:Y Z
B 氢化物的沸点:X>W
Z
B 氢化物的沸点:X>W
C.离子的还原性:X>W D 原子及离子半径:Z>Y>X
17、下列各组热化学方程式程中,化学反应的△H前者大于后者的是
①C(s)+O2(g)=CO2(g);△H1 C(s)+1/2O2(g)=CO(g);△H2
②S(s)+O2(g)=SO2(g);△H3 S(g)+O2(g)=SO2(g);△H4
③H2(g)+1/2O2(g)=H2O(g);△H5 2H2(g)+O2(g)=2H2O(l);△H6
④CaCO3(s)=CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)=Ca(OH)2(s);△H8
A、① B、④ C、②③④ D、①②③
16、元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列推测不正确的是
A.同周期元素中X的金属性最强 B.原子半径X>Y,离子半径X+>Z2-
C.同族元素中Z的氢化物稳定性最高
D.同周期元素中Y的最高价含氧酸的酸性最强
15、钢铁生锈过程发生如下反应:
①2Fe+O2+2H2O=2Fe(OH)2; ②4Fe(OH)2+O2+2H2O=4Fe(OH)3;③2Fe(OH)3=Fe2O3+3H2O。
下列说法正确的是
A.反应①、②中电子转移数目相等 B.反应①中氧化剂是氧气和水
C.与铜质水龙头连接处的钢质水管不易发生腐蚀
D.钢铁在潮湿的空气中不能发生电化学腐蚀
14、已知在298K时下述反应的有关数据:
C(s)+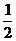 O2(g) === CO(g) △H1 = -110.5 kJ• mol-1
O2(g) === CO(g) △H1 = -110.5 kJ• mol-1
C(s)+O2(g) === CO2(g) △H2= -393.5 kJ• mol-1
则C(s)+CO2(g) === 2CO(g) 的△H 为( )
A. +283.5 kJ• mol-1 B. +172.5 kJ• mol-1 C. -172.5 kJ• mol-1 D. -504 kJ• mol-1
13、关于铅蓄电池的说法正确的是
A.在放电时,正极发生的反应是 Pb(s) +SO42-(aq)= PbSO4(s) +2e-
B.在放电时,该电池的负极材料是铅板
C.在充电时,电池中硫酸的浓度不断变小
D.在充电时,阳极发生的反应是 PbSO4(s)+2e-= Pb(s)+ SO42-(aq)
12、X、Y为短周期元素,X位于IA族,X与Y可形成化合物X2Y,下列说法正确的是
A.X的原子半径一定大于Y的原子半径
B.X与Y的简单离子不可能具有相同的电子层结构
C.两元素形成的化合物中,原子个数比不可能为1 :1
D.X2Y可能是离子化合物,也可能是共价化合物
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com