
13.(6分)m、n、x、y四种主族元素在周期表里的相对位置如下图所示。
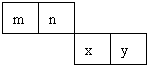
已知它们的原子序数总和为46,则:
(1) 元素n的气态氢化物的分子空间构型为 。
(2) m与y所形成的化合物含 键,属 分子。
(3) x的原子结构示意图为 。
(4) 由n、y的氢化物相互作用所生成的物质的电子式为 。
12.有五种元素X、Y、Z、Q、T,原子序数依次递增。X是形成化合物最多的元素,Y是地壳中含量最多的元素,Z原子的电子数是其最外层电子数的三倍,Q原子的M层上有六个电子,T是世界上应用得最广泛的过渡金属元素。下列叙述不正确的是 ( )
A.元素Y和T可形成一种化合物T2Y3
B.XY2是极性键构成的非极性分子
C.Z离子的半径比Q离子的半径小
D.X和Z各有一种单质的结构单元是正四面体
Ⅱ卷(50分)
班级 学号 姓名
11、短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍。下列说法正确的是 ( )
A X的氢化物溶于水显酸性
B Y的氧化物是离子化合物
C Z的氢化物的水溶液在空气中存放不易变质
D X和Z的最高价氧化物对应的水化物都是弱酸
10.下列各项叙述中一定能说明元素X的非金属性比元素Y的非金属性强的是 ( )
A.X原子在反应中得到的电子数比Y原子在反应中得到的电子数少
B.气态氢化物溶于水后的酸性,X比Y强
C.X的最高正价比Y的最高正价大
D.X单质能与Y的氢化物反应生成Y单质
9.短周期元素A和B可组成化学式为AB3的化合物。若A、B两元素的原子序数分别为a、b,则| a-b |的数值可能是 ( )
A.4、6、8、14 B.4、6、8、15
C.5、6、8、14 D.4.5、6、8、14
8.原子序数大于4的主族元素X和Y的离子Xm+、Yn-,核外电子排布相同。则关于X、Y两元素的叙述正确的是 ( )
A.X的原子序数小于Y的原子序数
B.X和Y的核电荷数之差是(m-n)
C.X和Y处于同一周期
D.Y元素的族序数与X元素的族序数之差为 8-(m+n)
7.M、N两种元素的原子,当它们每个原子获得两个电子形成稀有气体元素原子的电子层结构时,放出的能量M大于N,由此可知 ( )
A.N2- 的还原性小于M2- B.M单质的氧化性小于N
C.M的非金属性大于N D.M的原子半径大于N
6.下列各种关系的比较,正确的是 ( )
A.微粒半径:K+ > Na+ > Mg2+ > Ba2+; F > O > S > S2 -
B.密度:Cl2 > CH3CH2CH3 > C2H6 > N2(同温同压); Rb > K > Na > Li
C.熔沸点:H2Se > H2S > H2O; SiO2 > NaCl > Na
D.热稳定性:HF > HCl> H2S > PH3
5、下列关于粒子结构的描述不正确的是 ( )
A.H2S和NH3均是价电子总数为8的极性分子
B.HS-和HCl均是含一个极性键的18电子粒子
C.CH2C12和CH4均是四面体构型的非极性分子
D.1 mol D216O中含中子、质子、电子各10 NA(NA代表阿伏加德罗常数的值)
4、下列说法正确的是 ( )
A.两种元素组成的分子中一定只有极性键
B.含有阴离子的化合物一定含有阳离子
C.干冰升华时,分子内共价键会发生断裂
D.金属元素和非金属元素形成的化合物一定是离子化合物
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com