
20.25℃时,水的电离达到平衡:H2O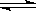 H++OH-;ΔH>0,下列叙述正确的是
H++OH-;ΔH>0,下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH―)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,pH不变
19. 有一电解池中X,Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的是( )
有一电解池中X,Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的是( )
|
组合 |
a极板 |
b极板 |
X电极 |
Z溶液 |
|
A |
锌 |
石墨 |
负极 |
CuSO4 |
|
B |
石墨 |
石墨 |
负极 |
NaOH |
|
C |
银 |
铁 |
正极 |
AgNO3 |
|
D |
铜 |
石墨 |
负极 |
CuCl2 |
18. 下列叙述正确的是
A.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)>c(NO3-)
B.常温下,同浓度的Na2S与NaHS溶液相比,NaHS溶液的pH大
C.等物质的量浓度的NH4Cl溶液和NH4HSO4溶液,后者的c(NH4+)大
D.能使红色石蕊变蓝的溶液中,Na+、S2-、Br-、NH4+等离子可以大量共存
17.工业上合成氨反应的能量变化如图所示,该反应的热化学方程式是
 A.N2(g)+3H2(g)=2NH3(l);
A.N2(g)+3H2(g)=2NH3(l);
ΔH=2(a-b-c) kJ·mol-1
B.N2(g)+3H2(g)=2NH3(g);
ΔH=2(b-a) kJ·mol-1
C. N2(g)+
N2(g)+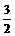 H2(g)=NH3(l);
H2(g)=NH3(l);
ΔH=(b+c-a) kJ·mol-1
D. N2(g)+
N2(g)+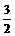 H2((g)=NH3(g);
H2((g)=NH3(g);
ΔH=(a+b) kJ·mol-1
16. 用已知浓度的盐酸滴定未知浓度的NaOH溶液,选用酚酞作指示剂,下列操作会导致测定结果偏低的是
A.酸式滴定管未润洗就装标准液滴定
B.锥形瓶未用待测液润洗
C.读取标准液读数时,滴前仰视,滴定到终点后俯视
D.滴定前酸式滴定管尖嘴处有气泡未排除,滴定后气泡消失
15.合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:
N2(g)+3H2(g)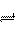 2NH3(g),673K,30Mpa
2NH3(g),673K,30Mpa
下n(NH3)和n(H2)随时间变化的关系如下图
 所示。下列叙述正确的是
所示。下列叙述正确的是
A.点a的正反应速率比点b的小
B.点 c处反应达到平衡
C.点d (t1时刻) 和点 e (t2时刻) 处
n(N2)不一样
D.其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值大
14.一种一元强酸HA溶液中加入一种碱MOH,溶液呈中性,下列判断正确的是
A.加入的碱过量 B.生成的盐发生水解
C.反应后溶液中c(A-)= c(M+) D.混合前酸与碱中溶质的物质的量相等
13.体积比为2∶3的N2和H2的混合气体,在一定条件下发生反应。达到平衡时,容器内压强为反应开始时的4/5,则N2的转化率为
A.50% B.37.5% C.25% D.12.5%
12.下列叙述正确的是
A.在原电池的负极和电解池的阴极上都发生失电子的氧化反应
B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1∶2
C.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 mol NaOH
D.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
11.在一定温度下的密闭容器中加入2molNO2,发生如下反应:2NO2 (g) 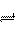 2 NO(g)+ O2(g),此反应达到平衡状态的标志是
2 NO(g)+ O2(g),此反应达到平衡状态的标志是
A.混合气体的颜色变浅
B.混合气体的密度不在发生变化
C.混合气体中NO2 、NO 、O2的物质的量之比为2:2:1
D.单位时间内生成2n mol NO 同时生成2n mol NO2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com