
28.(12分)实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
4NH4++6HCHO=3H++6H2O+(CH2)6N4H+ [滴定时,1 mol(CH2)6N4H+与 l mol H+相当],
然后用NaOH标准溶液滴定反应生成的酸,某兴趣小组用甲醛法进行了如下实验:
步骤I 称取样品1.500g。
步骤II 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数 (填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积
(填“偏大”、“偏小”或“无影响”)
③滴定时边滴边摇动锥形瓶,眼睛应观察
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由 色变成 色。
(2)滴定结果如下表所示:
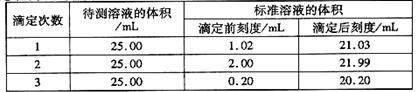
若NaOH标准溶液的浓度为0.1010mol·L-1则该样品中氮的质量分数为
27. (19分)羧酸与醇发生酯化反应,通常有不稳定的中间产物生成。例如:
(19分)羧酸与醇发生酯化反应,通常有不稳定的中间产物生成。例如:
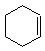
现以环已烯( )为原料,通过以下各步转化,最终可制得有机物
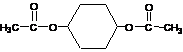
(部分反应过程及反应条件略去)
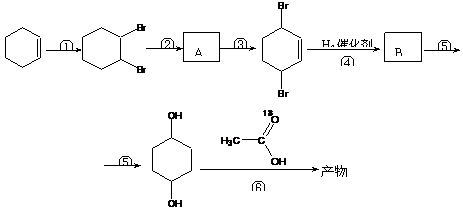
请回答下列问题:
⑴ 写出A、B的结构简式_______________、_______________
⑵ 反应②⑤的反应类型分别是________、_____________
⑶ 第⑥步发生的酯化反应最终所得的有机物是否一定含有18O?简述你的理由
__________________________________________________________
26.(15分)有A、B、C、D、E五种短周期元素,它们的原子序数依次增大.A的原子核无中子,能与B、C分别形成10电子的化合物;B、C的质子数之和与E的质子数相等,B、C的族序数为奇数;D、E位于同一周期,D的阳离子所带的正电荷数等于该阳离子的电子层数.试回答下列问题:
(1)C与D形成的化合物的电子式 .
(2)写出D的单质与CO2反应的化学方程式 .
(3)“嫦娥一号”发射所用的液体燃料是上述 (填元素名称)元素的单质.
(4)工业上,使元素E的低价氧化物转化为其最高价氧化物的设备名称为 .
(5)在一定的条件下,A2、B2混合物经过一段时间的反应后,B2的浓度减小了0. 3 mol/L.
此时间内A2表示的化学反应速率为0. 45 mol/(L·s).则此段反应时间为 s.
13.右表为元素周期表短周期的一部分。下列有关A、B、C、D、E五种元素的叙述中,不正确的是
|
|
|
|
|
|
|
A |
|
B |
C |
|
|
|
|
D |
E |
|
A.A与B形成的阴离子可能有:AB32-、A2B42-
B.E的氢化物的沸点比C的氢化物的沸点高
C.D在过量的B中燃烧的主要产物为DB2
D.由这5种元素中的几种形成只含极性键的非极性分子多于4种
12.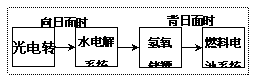 右图是某空间站能量转化系统的局部
右图是某空间站能量转化系统的局部
示意图,其中燃料电池采用KOH为电解液,
下列有关说法中不正确的是
A.该能量转化系统中的水也是可以循环的
B.燃料电池系统产生的能量实际上来自于水
C.水电解系统中的阳极反应:4OH--4e-=O2+2H2O
D.燃料电池放电时的负极反应:H2-2e-+2OH-=2H2O
10.在一定温度下,将等量的气体分别通入起始体积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是
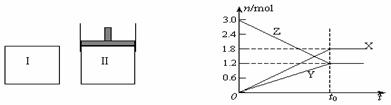
A.该反应的化学方程式为:3X+2Y 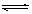 2Z
2Z
B.若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间等于t0
C.若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态
D.若达平衡后,对容器Ⅱ升高温度时其体积增大,说明Z发生的反应为吸热反应
11常温时,将V1 mL c1 mol·L-1的氨水滴加到V2 mL c2 mol·L-1的盐酸中,下述结论中正确的是
A.若混合溶液的pH=7则c1V1=c2V2 B.若V1=V2,c1=c2,则混合液中c(NH4+)=c(Cl-)
C.若混合液的pH=7,则混合液中c(NH4+)=c(Cl-)
D.若V1=V2,且混合液的pH<7,则一定有c1<c2
9.下列离子方程式正确的是
A.三氯化铝溶液中加入过量NaOH溶液:Al3++3OH―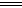 Al(OH)3↓
Al(OH)3↓
B.4mol/L的NaAlO2溶液和7mol/L的HCl等体积互相均匀混合:
4AlO2―+7H++H2O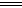 3Al(OH)3↓+Al3+
3Al(OH)3↓+Al3+
C.K37ClO3与浓盐酸(HCl)在加热时生成氯气: K37ClO3 + 6HCl = K37Cl + 3Cl2↑+ 3H2O
D.将0.1mol/L盐酸数滴缓缓滴入0.1mol/L25mLNa2CO3溶液中,并不断搅拌:
2H++CO32-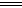 CO2↑+H2O
CO2↑+H2O
8.若阿伏加德罗常数为NA,下列叙述正确的是
A.2.24LCO2中含有的原子数为0.3 NA
B.0.1L 3 mol·L-1的NH4NO3溶液中含有的NH4+ 数目为0.3NA
C.5.6g铁粉与硝酸反应失去的电子数一定为0.3 NA
D.4.5 gSiO2晶体中含有的硅氧键数目为0.3 NA
7.下列实验中金属或氧化物可以完全溶解的是
A.0.1 mol铜片与含0.2 mol H2SO4的浓硫酸共热
B.0.1 mol MnO2粉末与含0.2 mol H2O2的溶液共热
C.常温下0.1mol铝片投入足量的浓硫酸中
D.常温下0.1mol铜片投入含0.4 mol HNO3的浓硝酸中
6.下列说法正确的是
A.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
B.用过滤法分离四氯化碳与聚乙烯的混合物
C.除去CO2中少量的SO2,使混合气体通过盛饱和碳酸钠溶液的洗气瓶
D.我国自主研发的“龙芯1号”CPU芯片与光导纤维是同种材料
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com