
18.如图所示,在一条直线上两个振动源A、B相距6.0m,振动频率相等。T0=0时刻A、B开始振动,振幅相等,且都只振动一个周期。甲、乙依次是A、B的振动图像。若A向右传播的波与B向左传播的波在t1=0.30s时同时传播到C点,则
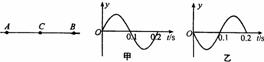 A、两列波的传播速度均为20m/s
A、两列波的传播速度均为20m/s
B、两列波的波长都是4.0m
C、在两列波相遇过程中,C点为振动加强点
D、t2=0.7s时刻B点正处在平衡位置且向下运动
答案:D。解析:因A向右传播的波与B向左传播的波在时同时传播到C点,则两列波在A、B间的传播速度均为10m/s,A错;从图像上读出周期为T=0.2s,所以波长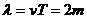 ,B错;因A、B振动步调相反,所以C点是振动减弱点,C错;在t2=0.7s时刻,B点的振动是由A波引起。可知t=0.7时,B点正处在平衡位置且向下运动,D正确。
,B错;因A、B振动步调相反,所以C点是振动减弱点,C错;在t2=0.7s时刻,B点的振动是由A波引起。可知t=0.7时,B点正处在平衡位置且向下运动,D正确。
17.如图所示,一个小物体沿光滑斜面由A点上方从静止开始加速下滑,在它通过的路径中取AE并分成相等的四段,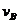 表示通过B点时的瞬时速度,
表示通过B点时的瞬时速度,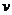 表示AE段的平均速度,则
表示AE段的平均速度,则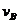 与
与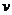 的关系是( )
的关系是( )
A.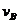 <
<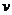
 B.
B.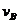 =
=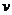
C.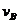 >
>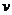
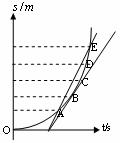 D.以上三种关系都有可能
D.以上三种关系都有可能
[答案]A
[解析]由于物体的整个运动是匀加速直线运动,即满足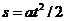 ,位移图象是顶点在原点的抛物线,根据位移图象斜率的意义可知,过B点作切线表示运动质点在B点时的瞬时速度,连接AE,直线AE的斜率表示运动质点在AE段的平均速度,比较可知,AE线的斜率大于B点切线的斜率,即有
,位移图象是顶点在原点的抛物线,根据位移图象斜率的意义可知,过B点作切线表示运动质点在B点时的瞬时速度,连接AE,直线AE的斜率表示运动质点在AE段的平均速度,比较可知,AE线的斜率大于B点切线的斜率,即有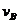 <
<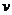 ,故选项A是正确的。
,故选项A是正确的。
16.在对“嫦娥一号”卫星对月球探索中,发现月球土壤里大量存在着一种叫做“氦3(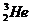 )”的化学元素,是热核聚变的重要原料。科学家初步估计月球上至少有100万吨氦3,如果相关技术开发成功,将可为地球带来取之不尽的能源。关于“氦3(
)”的化学元素,是热核聚变的重要原料。科学家初步估计月球上至少有100万吨氦3,如果相关技术开发成功,将可为地球带来取之不尽的能源。关于“氦3(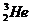 )”与氘核聚变,下列说法中正确的是( )
)”与氘核聚变,下列说法中正确的是( )
A.核反应方程为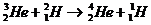
B.核反应生成物的质量将大于参加反应物质的质量
C.氦3(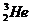 )一个核子的结合能大于氦4(
)一个核子的结合能大于氦4(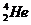 )一个核子的结合能
)一个核子的结合能
D.氦3(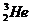 )的原子核与一个氘核发生聚变将放出能量
)的原子核与一个氘核发生聚变将放出能量
[答案]AD
[解析]核反应方程为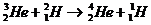 ,“氦
,“氦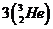 ”与氘核聚变的核反应符合质量数与电荷数守恒,且聚变是放能反应,A正确;放出能量,质量减少,B错误,D正确;由原子结构知识可知C错误。
”与氘核聚变的核反应符合质量数与电荷数守恒,且聚变是放能反应,A正确;放出能量,质量减少,B错误,D正确;由原子结构知识可知C错误。
15.在杨氏双缝干涉实验中,以下情况可能出现的有( )
A.用白光作为光源,屏上的中央条纹为白色亮条纹
B.用蓝光作为光源,屏上将呈现蓝白相间的条纹
C.用红光照射两条狭缝,如果改变两条狭缝之间的距离,屏上的彩色条纹分布况状不变
D.用紫光作为光源,遮住其中一条狭缝,屏上将呈现间距不等的条纹
[答案] AD
[解析]白光作杨氏双缝干涉实验,屏上将呈现中央条纹为白色亮条纹而两边对称出现彩色条纹,A对;用蓝光作光源,屏上将呈现蓝色亮条纹与暗条纹(即黑条纹)相间,B错;如果改变两条狭缝之间的距离,屏上的条纹必然改变,C错;紫光作光源,遮住一条狭缝,屏上出现单缝衍射条纹,即间距不等的条纹,D对。
14.对于一定质量的理想气体
A.体积和压强增大,气体一定吸收热量
B.体积和压强减小,气体一定吸收热量
C.体积和温度增大,气体一定放出热量
D.压强和温度减小,气体内能不一定减小
[答案]A
[解析]P、V增大,由=恒量知,T必增大,对理想气体,内能增加,由热力学第一定律:△U=W+Q,△U取正值,体积增大,气体对外做功,W取负值,则Q必取正值,即气体一定吸收热量,A对;同理,P、V减小,△U取负值,体积减小,外界对气体做功,W取正值,则Q必取负值,即气体一定放出热量,B错;V、T增大,△U取正值,体积增大,气体对外做功,W取负值,则Q必取正值,即气体一定吸收热量,C错;对D选项,T减小,对理想气体内能一定减小,D错.
13.下列关于化学键和晶体的说法正确的是 ( )
A.离子晶体中只有离子键
B.非金属元素只能形成共价键
C.水分子中存在氢键,所以水的沸点较高
D.原子晶体的熔点不一定比金属晶体的熔点高
答案:D。
解析:离子晶体中还可以含有共价键,A错误;非金属元素也能形成离子键,如氯化铵等,B错误;水分子间存在氢键,所以水的沸点较高,C错误。
12.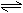 已知H2(g)+I2(g) 2HI(g);△H<0。有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
已知H2(g)+I2(g) 2HI(g);△H<0。有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
A.甲升高温度,乙不变
B.甲中加入0.1molHe,乙不变
C.甲、乙提高相同温度
D.甲增加0.1molH2,乙不变
答案:D。
解析:达到平衡时,甲和乙等效。A项甲升高温度,平衡逆向移动,HI的平衡浓度变小;B项甲中加入0.1molHe,平衡不移动;C项甲、乙提高相同温度,达到平衡效果还是相同;D项甲增加0.1molH2,平衡正向移动,HI的平衡浓度增大。
11.NA代表阿伏加德罗常数的值。下列有关叙述正确的是 ( )
A.标准状况下,2.24LC6H14中含有1.9NA个共用电子对
B.7.8gNa2O2固体中含阴离子数目为0.1NA
C.含36.5gHCl的浓盐酸与足量的二氧化锰作用,能产生0.25NA个氯气分子
D.5.6gFe与足量的氯气反应转移的电子数目为0.2NA
答案:B。
解析:A中气体摩尔体积适用的是标准状况下的气体,对固体和液体不适用,在标准状况下C6H14为液体;C中随着反应的进行浓盐酸变稀,稀盐酸不与二氧化锰反应,所以产生的氯气小于0.25NA个;D中转移的电子数目为0.3NA。
10.答案:D。
解析:制氧气时排水法收集氧气后出现倒吸现象,应立即把导管拿出水面,A错误;可燃性气体点燃前均需检验纯度。B错误;白磷易自燃,用剩后要放回原瓶,CS2易挥发,不能溶解在其中倒入垃圾箱,会造成火灾。C错误。
10.化学是以实验为基础的自然科学,化学实验设计和操作中必须十分重视师生安全问题和环境保护问题。下列实验问题处理方法正确的是 ( )
A.制氧气时排水法收集氧气后出现倒吸现象,应立即停止加热
B.在气体发生装置上直接点燃乙炔气体时,不需先检验乙炔气体的纯度
C.白磷在空气中易自燃,用剩的白磷可溶解于CS2后倒入垃圾箱
D.给试管中的液体加热时,可加入碎瓷片或不时移动试管,以免暴沸伤人
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com