
13.某溶液中可能存在:Br–、CO32–、SO32–、Al3+、I–、Mg2+、Na+等7种离子中的几种。现取该溶液进行实验,得到如下实验现象:①向溶液中滴加足量氯水后,溶液变橙色,有无色气泡冒出;②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。据此可以推断,该溶液中肯定不存在的离子是
A.Mg2+、Na+、CO32–、I– B.Al3+、Mg2+、I–、SO32–
C.Al3+、Na+、SO32–、I– D.Al3+、CO32–、Br–、SO32–
12. NA代表阿伏加德罗常数,下列叙述错误的是
NA代表阿伏加德罗常数,下列叙述错误的是
A.10 mL 质量分数为98%的H2SO4,用水稀释至100mL , H2SO4的质量分数为9.8 %
B.在H2O2+Cl2=2HCl+O2反应中,每生成32g 氧气,则转移2NA个电子
C.标准状况下,分子数为NA的CO、C2H4 混合气体体积约为22.4L,质量为28g
D.标准状况下,336L丙烯中含有的非极性键数为45NA
11.将甲和乙气体按1:1同时通入过量丙溶液中,充分反应后一定产生沉淀的组合是
|
序号 |
甲 |
乙 |
丙 |
|
① |
CO2 |
SO2 |
Ca(OH)2 |
|
② |
HCl |
CO2 |
Ca(OH)2 |
|
③ |
CO2 |
SO2 |
Ba(NO3)2 |
|
④ |
NO2 |
SO2 |
BaCl2 |
|
⑤ |
CO2 |
NH3 |
CaCl2 |
|
⑥ |
O2 |
NH3 |
AlCl3 |
A.①②⑤ B.①③④⑤⑥ C.①②③④⑥ D.全部
10.下列叙述正确的是
A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO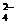 )>c(NH
)>c(NH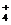 )
)
B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C.室温pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.用惰性电极电解CuCl2溶液:
9.某种氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是
A.正极反应式为:O2+2H2O+4e-=4OH-
B.工作一段时间后,电解液中KOH的物质的量不变
C.该燃料电池的总反应方程式为:2H2+O2=2H2O
D.用该电池电解CuCl2溶液,产生2.24 L Cl2(标准状况)时,有0.1 mol电子转移
8.下列各组离子在给定条件下能大量共存的是
A.在pH=1的溶液中:NH4+、K+、ClO-、Cl-
B.有SO42-存在的溶液中:Na+、Mg2+、Ca2+、I-
C.在c(H+)=1.0×10-13mol·L-1的溶液中:Na+、S2-、AlO2-、SO32-
D.含有大量Fe3+的溶液:SCN-、I-、K+、Br-
7.工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)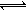 Si(s)+4HCl(g);△H=+QkJ/mol(Q>0)某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是
Si(s)+4HCl(g);△H=+QkJ/mol(Q>0)某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ
C.反应至4min时,若HCl浓度为0.12mol/L,则H2的反应速率为0.03mol/(L min)
min)
D.反应吸收热量0.025QkJ时,生成的HCl通入100mL 1mol/L的NaOH溶液恰好反应
6.下列叙述正确的是
A.分子晶体中都存在范德瓦耳斯力,分子内可能不存在共价键
B.HF、HCl、HBr、Hl的稳定性依次增强,CS2、H2O、C2H2都是直线型分子
C.与强酸、强碱都反应的物质只有两性氧化物或两性氢氧化物
D.金属与盐溶液的反应都是置换反应,阴离子都只有还原性
5.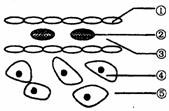 右图为哺乳动物某组织示意图,其中①是毛细血管壁,②是成熟红细胞,③是血浆,④是细胞内液,⑤是组织液。
右图为哺乳动物某组织示意图,其中①是毛细血管壁,②是成熟红细胞,③是血浆,④是细胞内液,⑤是组织液。
下列相关叙述正确的是:
|
B.组织胺能使①通透性增大,从而导致⑤中液体减少
C.过敏反应产生的抗体主要分布在③中,③和⑤的成分有区别
D.②中的氧气到达④至少需要经过4层生物膜,②处氧气浓度高于④
4.下列关于基因工程的叙述中正确的是:
A.源于原核生物的目的基因不能导入真核细胞
B.用质粒做运载体是由于所有生物都有质粒
C.DNA连接酶的作用是催化碱基对之间的氢键形成
D.只要露出的黏性末端相同,就可以用不同的限制酶分别切取质粒和目的基因
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com