
7.设服从二项分布B(n,p)的随机变量ξ的期望和方差分别是2.4与1.44,则二项分布的参数n、p的值为
A.n=4,p=0.6 B.n=6,p=0.4 C.n=8,p=0.3 D.n=24,p=0.1
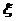 |
0 |
1 |
2 |
3 |
 |
0.1 |
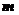 |
 |
0.1 |
6.甲,乙两人独立地解同一问题,甲解决这个问题的概率是P1,乙解决这个问题的概率是P2,那么其中至少有1人解决这个问题的概率是
A.P1+P2 B.P1P2
C.1-P1 P2 D.1-(1–P1)(1–P2)
5.二项式(2x3- )5的展开式中含x5的项是
)5的展开式中含x5的项是
A.第3项 B.第4项 C.第5项 D.第6项
4.点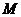 的直角坐标是
的直角坐标是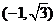 ,则点
,则点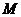 的极坐标为
的极坐标为
A.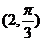 B.
B.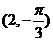
C.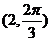 D.
D.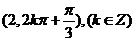
3.五种不同商品在货架上排成一排,其中A、B两种必须连排,而C、D两种不能连排,则不同排法共有
A.12 B.20 C.24 D.48
2. 一位母亲记录了儿子3-9岁的身高,数据(略),由此建立的身高与年龄的回归模型为y=7.19x+73.93,用这个模型预测这个孩子10岁时的身高,则正确的叙述是
A.身高一定是145.83cm B.身高在145.83cm以上
C.身高在145.83cm左右 D.身高在145.83cm以下
1.设集合A={a,b,c,d,e},B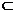 A,已知a∈B,且B中含有3个元素,则集合B有
A,已知a∈B,且B中含有3个元素,则集合B有
A.A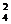 个
B.C
个
B.C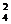 个 C.A
个 C.A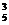 个 D.C
个 D.C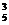 个
个
31.(14分)在80℃时,0.40mol的N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)  2 NO2(g) ΔH>0 ,隔一段时间对该容器内的物质进行分析得到如下数据:
2 NO2(g) ΔH>0 ,隔一段时间对该容器内的物质进行分析得到如下数据:
 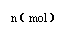 |
0 |
20 |
40 |
60 |
80 |
100 |
|
n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
|
n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
(1)求b、e的值:b= ,e=
(2)计算20s-40s内用N2O4表示的平均反应速率为 ;80℃该反应的化学平衡常数K为 。
(3)改变条件并达到新平衡,要使NO2在平衡体系中的含量变小,可采取的措施有(填序号) 。
A.向混合气体中再通入N2O4 B.保持容积不变,通入He
C.使用高效催化剂 D.降低温度
 (4)如果在80℃、将0.40mol的N2O4气体放入一个起始体积为2L、且压强维持不变的容器中发生上述反应。则达到平衡时n(NO2) 0.60mol(填“ 大于 ” “等于” 或“ 小于”)
(4)如果在80℃、将0.40mol的N2O4气体放入一个起始体积为2L、且压强维持不变的容器中发生上述反应。则达到平衡时n(NO2) 0.60mol(填“ 大于 ” “等于” 或“ 小于”)
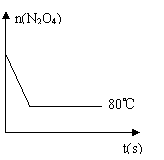
(5)如图是80℃时容器中N2O4物质的量的
变化曲线,请在该图中补画出该反应在60℃时
N2O4物质的量的变化曲线
29.(9分)某化学实验小组从市场上买来一瓶某品牌食用白醋(主要是醋酸的水溶液),用实验室标准NaOH溶液对其进行滴定以测定它的准确浓度,完全反应时所得溶液pH大致为9 。下表是4种常见指示剂的变色范围:
|
指示剂 |
石蕊 |
甲基橙 |
甲基红 |
酚酞 |
|
变色范围(pH) |
5.0-8.0 |
3.1-4.4 |
4.4-6.2 |
8.2-10.0 |
(1)该实验应选用 作指示剂。
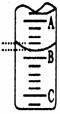 (2)右图表示50mL滴定管中液面的位置,若A与C刻度间
(2)右图表示50mL滴定管中液面的位置,若A与C刻度间
相差1mL,A处的刻度为25,滴定管中液面读数应为 mL;
反应达滴定终点时的现象为 。
(3)为减小实验误差,该同学一共进行了三次实验,假设每
次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次
实验结果记录如下:
|
实验次数 |
第一次 |
第二次 |
第三次 |
|
消耗NaOH溶液体积/mL |
26.02 |
25.35 |
25.30 |
 从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是 。
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是 。
A.实验结束时,俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束尖嘴部分充满溶液
C.盛装白醋溶液的滴定管用蒸馏水洗过,未用白醋溶液润洗
D.锥形瓶预先用食用白醋润洗过
E.滴加NaOH溶液时,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):C= mol/L。
|
 2CH3OH+3O2+4KOH
2CH3OH+3O2+4KOH 2K2CO3+6H2O
(1)请回答图中甲、乙两池的有关问题:
甲池是 装置,
B(石墨)电极的名称是 。
(2)写出电极反应式:
通入O2的电极的反应式 。
A(Pt)电极的反应式为 ,
(3)乙池中反应的化学方程式为 。
(4)若乙池溶液体积为500mL,且忽略电解过程中溶液体积的变化,当乙池中A极的质量增加5.40g时:
①甲池中理论上消耗O2体积为 (标准状况下);
②乙池中所得溶液的pH= 。
28.下列有关判断正确的是
A.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+
B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为: Al-3e-+3OH-=Al(OH)3
C.由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+ D.用原电池和电解池装置都能实现2HCl + Cu CuCl2
+ H2↑ 反应
CuCl2
+ H2↑ 反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com