
3.孔子心目中的理想社会是
A.君主专制社会 B.民主共和社会
C.法治社会 D.礼与仁相结合的社会
2.下列孔子的思想中能够体现以民为本的是
①“仁者爱人” ②“己所不欲,勿施于人” ③“为政以德” ④“节用而爱人”
A.①②③ B.②③④ C.①③④ D.①②③④
1.孔子思想的核心是
A.“仁” B.“仁政” C.“爱人” D.“节用而爱人”
31.(14分)在80℃时,0.40mol的N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)  2 NO2(g) ΔH>0 ,隔一段时间对该容器内的物质进行分析得到如下数据:
2 NO2(g) ΔH>0 ,隔一段时间对该容器内的物质进行分析得到如下数据:
 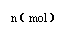 |
0 |
20 |
40 |
60 |
80 |
100 |
|
n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
|
n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
(1)求b、e的值:b= ,e=
(2)计算20s-40s内用N2O4表示的平均反应速率为 ;80℃该反应的化学平衡常数K为 。
(3)改变条件并达到新平衡,要使NO2在平衡体系中的含量变小,可采取的措施有(填序号) 。
A.向混合气体中再通入N2O4 B.保持容积不变,通入He
C.使用高效催化剂 D.降低温度
 (4)如果在80℃、将0.40mol的N2O4气体放入一个起始体积为2L、且压强维持不变的容器中发生上述反应。则达到平衡时n(NO2) 0.60mol(填“ 大于 ” “等于” 或“ 小于”)
(4)如果在80℃、将0.40mol的N2O4气体放入一个起始体积为2L、且压强维持不变的容器中发生上述反应。则达到平衡时n(NO2) 0.60mol(填“ 大于 ” “等于” 或“ 小于”)
(5)如图是80℃时容器中N2O4物质的量的
变化曲线,请在该图中补画出该反应在60℃时
N2O4物质的量的变化曲线
29.(9分)某化学实验小组从市场上买来一瓶某品牌食用白醋(主要是醋酸的水溶液),用实验室标准NaOH溶液对其进行滴定以测定它的准确浓度,完全反应时所得溶液pH大致为9 。下表是4种常见指示剂的变色范围:
|
指示剂 |
石蕊 |
甲基橙 |
甲基红 |
酚酞 |
|
变色范围(pH) |
5.0-8.0 |
3.1-4.4 |
4.4-6.2 |
8.2-10.0 |
(1)该实验应选用 作指示剂。
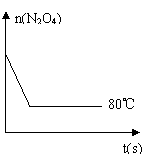
 (2)右图表示50mL滴定管中液面的位置,若A与C刻度间
(2)右图表示50mL滴定管中液面的位置,若A与C刻度间
相差1mL,A处的刻度为25,滴定管中液面读数应为 mL;
反应达滴定终点时的现象为 。
(3)为减小实验误差,该同学一共进行了三次实验,假设每
次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次
实验结果记录如下:
|
实验次数 |
第一次 |
第二次 |
第三次 |
|
消耗NaOH溶液体积/mL |
26.02 |
25.35 |
25.30 |
 从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是 。
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是 。
A.实验结束时,俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束尖嘴部分充满溶液
C.盛装白醋溶液的滴定管用蒸馏水洗过,未用白醋溶液润洗
D.锥形瓶预先用食用白醋润洗过
E.滴加NaOH溶液时,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):C= mol/L。
|
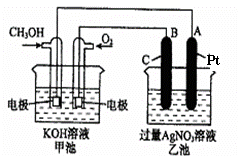 2CH3OH+3O2+4KOH
2CH3OH+3O2+4KOH 2K2CO3+6H2O
(1)请回答图中甲、乙两池的有关问题:
甲池是 装置,
B(石墨)电极的名称是 。
(2)写出电极反应式:
通入O2的电极的反应式 。
A(Pt)电极的反应式为 ,
(3)乙池中反应的化学方程式为 。
(4)若乙池溶液体积为500mL,且忽略电解过程中溶液体积的变化,当乙池中A极的质量增加5.40g时:
①甲池中理论上消耗O2体积为 (标准状况下);
②乙池中所得溶液的pH= 。
28.下列有关判断正确的是
A.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+
B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为: Al-3e-+3OH-=Al(OH)3
C.由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+ D.用原电池和电解池装置都能实现2HCl + Cu CuCl2
+ H2↑ 反应
CuCl2
+ H2↑ 反应
27.已知:在100℃时,纯水的c(H+)为1×10-6,此时将pH=12的NaOH溶液V1 L与pH=l的H2SO4溶液V2 L混合,若所得混合溶液的pH=10,则V1∶V2为
A.1∶9 B.10∶1 C.9∶1 D.1∶10
26.有等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是
A.V3>V2>V1 B.V3=V2=V1 C.V1=V2>V3 D.V3>V2=V1
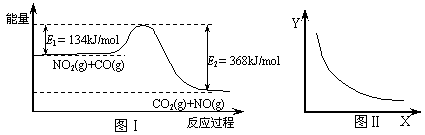
25.下图Ⅰ是NO2(g)+CO(g)  CO2(g)+NO(g) 反应过程中能量示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ。下列有关说法正确的是
CO2(g)+NO(g) 反应过程中能量示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ。下列有关说法正确的是
A.该反应的焓变△H=234kJ/mol
B.若X表示CO的起始浓度,则Y表示的可能是NO2的转化率
C.若X表示温度,则Y表示的可能是CO2的物质的量浓度
D.若X表示反应时间,则Y表示的可能是混合气体的密度
24.在以下四种溶液中,各离子一定能大量共存的是
A.滴加酚酞试液显红色的溶液:Fe3+、NH4+、Cl-、CO32-
B.所含溶质为MgCl2的溶液:K+、NO3-、SO42-、Al3+
C.水电离出来的c(H+)=10-13mol/L的溶液:K+、Na+、HCO3-、Br-
D.pH=1的溶液: Fe2+、Na+、I-、NO3-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com