
4.已知数列 满足
满足 ,则
,则 等于( )
等于( )
A. B.
B.
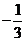 C.
1 D.
2
C.
1 D.
2
3.已知数列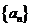 的通项公式是
的通项公式是 =
= ,则220是这个数列的( )
,则220是这个数列的( )
A.第19项 B.第20项 C.第21项 D.第22项
2. ( )
( )
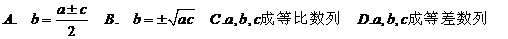
1.在 中,已知角
中,已知角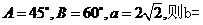 ( )
( )
A. B.
B.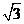 C.
C.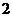 D.
D.
29.(12分)A、B、C、D、E均为可溶于水的固体,组成它们的离子有
|
阳离子 |
Na+ Mg2+ Al3+
Ba2+ |
|
阴离子 |
OH
Cl CO32-
HSO-4 |
分别取它们的水溶液进行实验。结果如下:
①A溶液与B溶液反应生成白色沉淀,沉淀可溶于E溶液;
②A溶液与C溶液反应生白色沉淀,沉淀可溶于E溶液;
③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;
④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失。据此推断它们是A ;B ;C ;D
河北省正定中学2010高一第二学期第一次考试
28.(21分)有A、B、C、D、E五种短周期元素,A元素的一种同位素原子核内不含中子,其单质为气体;B原子最外层电子数是次外层电子数的3倍,C 2+与B元素的离子具有相同的电子层结构;D与E原子具有相同的电子层数,且次外层电子数均为8;在同周期主族元素中原子半径E最大,D最小。回答下列问题:
(1)C 2+离子与D原子的结构示意图分别为: 、 。
(2)B和E形成的两种化合物的电子式是: 、
其中之一可与A 和B形成的化合物反应得到游离态B,写出该反应的化学方程式:
。
(3)由这五种元素中的几种形成的化合物中碱性最强的是 (化学式),
含氧酸酸性最强的是 (化学式)。
27.(12分)(1)已知20.0gNaOH稀溶液跟足量稀盐酸反应,放出28.68kJ热量,那么此反应数据表明:如果NaOH稀溶液跟稀盐酸中和生成18g水时,该反应放出热量_________________kJ,由此测得的中和热为___________kJ/mol
(2)已知断开1 molH-H键、1mol Br-Br键、1mol H-Br键分别需要吸收的能量为436kJ、193kJ、366kJ.。 计算H2和Br2反应生成1mol HBr需_______(填“吸收”或“放出”)能量_______kJ。
26.(15分)(1)分别用电子式表示HClO、MgCl2的形成过程
(2)已知下列原电池的总反应式:Cu+2FeCl3==CuCl2+2FeCl2,请写出电极反应式:
 正极反应式为:
正极反应式为:
负极反应式为:
(3) 如图所示,在锥形瓶放置有装有水的小试管,往小试管中分别加入下列物质时:①烧碱固体 ②浓硫酸 ③硝酸铵固体 ④NaCl固体,其中能使a端液面高于b端液面的是____________。(填序号)
25. 在25 ℃,101 kPa下,1 mol的白磷(化学式为P4)完全燃烧放出的热量比4 mol的红磷(化学式为P)完全燃烧放出的热量多。反应方程式分别为:
P4 (s) + 5O2 (g) = P4O10 (s) 4P (s)+ 5O2 (g) = P4O10 (s)
由此判断,下列说法正确的是( )
A.由红磷转化为白磷是吸热反应,等质量时红磷能量比白磷高
B.由红磷转化为白磷是放热反应,等质量时红磷能量比白磷低
C.由红磷转化为白磷是放热反应,等质量时红磷能量比白磷高
D.由红磷转化为白磷是吸热反应,等质量时红磷能量比白磷低
第Ⅱ卷(非选择题,共60分)
24. 将V1mL1.0mol·L-1
HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是( )
将V1mL1.0mol·L-1
HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是( )
A.做该实验时环境温度为22℃
B.该实验表明化学能可能转化为热能
C.NaOH溶液的浓度约为1.0mol/L·L-1
D.该实验表明有水生成的反应都是放热反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com