
30、已知25℃、101kPa条件下:4Al(s)+3O2(g)==2Al2O3(s);△H=-2834.9kJ·mol-1
4Al(s)+2O3(g)==2Al2O3(s);△H=-3119.1kJ·mol-1
由此得出的正确结论是( )w.w.^w.k.&s.5*
A.等质量的O2比O3能量低,由O2变O3为吸热反应
B.等质量的O2比O3能量低,由O2变O3为放热反应
C.O3比O2稳定,由O2变O3为吸热反应
D.O2比O3稳定,由O2变O3为放热反应
Ⅱ卷(共50分)请将答案填写在答卷纸的相应位置上
29. 已知CsCl晶体的密度为
已知CsCl晶体的密度为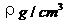 ,NA为阿伏加德罗常数,相邻的两个
,NA为阿伏加德罗常数,相邻的两个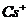 的核间距为a cm,如图所示,则CsCl的式量可以表示为 ( )
的核间距为a cm,如图所示,则CsCl的式量可以表示为 ( )
A. 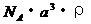 B.
B.
C. 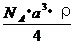 D.
D.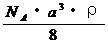
28、氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:
Al2O3 + N2
+ 3 C  2 AlN + 3 CO 下列叙述正确的是 ( )
2 AlN + 3 CO 下列叙述正确的是 ( )
A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中每生成2 mol AlN,N2得到3 mol电子
C.氮化铝中氮元素的化合价为-3
D.氮化铝晶体属于分子晶体
27.下列说法中正确的是 ( )
A.NH3、PCl5、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8e- 稳定结构
B.P4和CH4都是正四面体分子且键角都为109o28ˊ
C.NaCl晶体中与每个Na+距离相等且最近的Na+共有12个
D.由原子间通过共价键而形成的晶体一定具有高的熔、沸点及硬度
26.下列叙述正确的是 ( )
A、直径介于1-100nm 之间的微粒称为胶体 B、电泳现象可证明胶体属电解质溶液
C、利用丁达尔效应可以区别溶液和胶体 D、胶体粒子很小,可以透过半透膜
25.有下列离子晶体的空间结构示意图。图中●和化学式中M分别代表阳离子,图中○和化学式中N分别代表阴离子,则化学式为MN2的晶体结构为 ( w.w.^w.k.&s.5* )
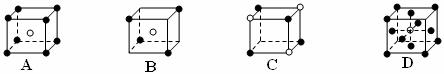
24、下列说法正确的是
A、△H >0表示反应放热,△H< 0表示反应吸热。
B、热化学方程式中的化学计量数表示物质的量,可以是分数
C、1molH2SO4与1molBa(OH)2反应生成BaSO4沉淀时释放出的热叫中和热
D、1molH2和0.5molO2反应放出的热就是H2的燃烧热
23、下列反应的离子方程式错误的是( )
A、向碳酸氢钙溶液中加人过量氢氧化钠Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
B、等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合
Ba2++2OH-+NH4++HCO3-==BaCO3↓+NH3·H2O+H2O
C、氢氧化铝与足量盐酸反应: Al(OH)3+3H+==Al3++3H2O
D、过量CO2通入氢氧化钠溶液中: CO2+2OH-==CO32-+H2O
22.在晶体中与中心离子(或原子)直接成键的离子(或原子)称为配位离子(或原子)。配位离子(或原子)的数目称为配位数。在NaCl晶体中Na+、Cl-的配位数都是: ( )
A.8 B.6 C.12 D.4
21.下列叙述不正确的是 ( )
A.含有非极性键的分子都是非极性分子
B.完全由极性键形成的分子不一定是极性分子
C.由共价键结合而成的化合物,其晶体为原子晶体
D.如果晶体中既含有离子键,又有共价键,这样的晶体属于离子晶体。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com