
3. 氢原子的能级图如图所示,一群氢原子处于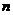 =3的激发态,在向基态跃迁 的过程中,下列说法中正确的是( )
=3的激发态,在向基态跃迁 的过程中,下列说法中正确的是( )
A.  这群氢原子能发出三种频率不同的光,其中
这群氢原子能发出三种频率不同的光,其中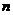 =3能级跃迁到
=3能级跃迁到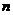 =2
=2
能级所发出光的波长最短
B.这群氢原子如果从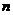 =3能级跃迁到
=3能级跃迁到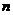 =1能级所发出光恰好使某金属发生光电效应,则从
=1能级所发出光恰好使某金属发生光电效应,则从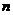 =3能级跃迁到
=3能级跃迁到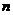 =2能级所发出光一定不能使该金属发生光电效应现象
=2能级所发出光一定不能使该金属发生光电效应现象
C.用这群氢原子所发出的光照射逸出功为2.49 eV的金属钠,则从金属钠表面所发出的光电子的最大初动能可能为11.11 eV
D.用这群氢原子所发出的光照射逸出功为2.49 eV的金属钠,则从金属钠表面所发出的光电子的最大初动能可能为9.60 eV
2. .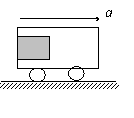 如图所示,小车向右做匀加速直线运动,物块M贴在小车左壁上,且相对 于左壁静止。当小车的加速度增大时,下列说法正确的是( )
如图所示,小车向右做匀加速直线运动,物块M贴在小车左壁上,且相对 于左壁静止。当小车的加速度增大时,下列说法正确的是( )
A.物块受到的弹力不变 B.物块受到的摩擦力不变
C.车厢壁对物块的作用力的方向不变 D.物块受到的合外力增大
1.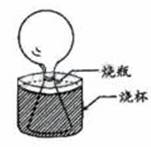 先把空的烧瓶放到冰箱冷冻,一小时后取出烧瓶,并迅速把一个气球紧密的套在 瓶颈上,然后将烧瓶放进盛满热水的烧杯里,气球逐渐膨胀起来,如图所示。此时烧瓶里的气体( )
先把空的烧瓶放到冰箱冷冻,一小时后取出烧瓶,并迅速把一个气球紧密的套在 瓶颈上,然后将烧瓶放进盛满热水的烧杯里,气球逐渐膨胀起来,如图所示。此时烧瓶里的气体( )
A.吸收热量,内能减小,对外做功 B. 吸收热量,内能增大,对外做功
C. 吸收热量,内能增大,外界对气体做功D. 放出热量,内能增大,对外做功
37.(4分) 晶体是质点(分子、离子或原子等)在空间有规则地排列、具有整齐外形、以多面体出现的固体物质。在空间里无限地周期性的重复能形成晶体的、具有代表性的最小单元,称为晶胞。一种Al-Fe合金的立体晶胞如下图所示。w.w.^w.k.&s.5*
|
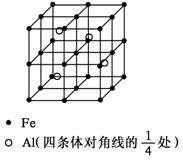
请据此回答下列问题:
(1) 确定该合金的化学式____________。
(2) 若晶体的密度为ρ g/cm3,NA为阿伏加德罗常数,则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为___________________cm。w.w.^w.k.&s.5*
w.w.^w.k.&s.5*
衡水中学2009-2010学年度第二学期期中考试
36、(4分)已知1molCO气体完全燃烧生成CO2气体放出283kJ的热量,1molH2气体完全燃烧生成液态水放出286kJ的热量,1molCH4气体完全燃烧生成CO2气体和液态水放出890kJ的热量
(1)写出H2完全燃烧的热化学方程式 。(2)若1molCH4气体完全燃烧生成CO2气体和水蒸气放出的热量 890kJ
(填>、<或=)
(3)若将amolCH4、CO和H2的混合气体完全燃烧,生成CO2气体和液态水,放出热量(Q)的取值范围是 。
(4)若将amolCH4、CO和H2的混合气体完全燃烧,生成CO2气体和液态水,且CO2和水的物质的量相等时,放出热量(Q)的取值范围是 。
35.(9分)某实验小组设计用50 mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液进行中和反应,测定中和热,中和热测定实验的关键是要比较准确地配制一定物质的量浓度的溶液,量热器要尽量做到绝热;在量热的过程中要尽量避免热量的散失,比较准确地测量出反应前后溶液温度的变化。回答下列问题:
(1)中和热的测定所需的玻璃仪器有
(2)本实验中用稍过量的NaOH的原因是 。
(3)在反应中若因为有放热现象,而造成少量HCl挥发,则测得的中和热数值 (填偏高、偏低或不变);
(4)该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据。
|
实验序号 w. |
起始温度t1/℃ w.w.^w.k.&s.5* |
终止温度(t2)℃ |
温差(t2-t1)℃ |
||
|
盐酸 |
NaOH溶液 |
平均值 |
|||
|
1 |
25.1 |
24.9 |
25.0 |
31.6 w.w.^w.k.&s.5* |
6.6 |
|
2 |
25.1 |
25.1 |
25.1 |
31.8 w.w.^w.k.&s.5* |
6.7 |
|
3 |
25.1 |
25.1 |
25.1 w.w.^w.k.&s.5* |
31.9 w.w.^w.k.&s.5* |
6.8 |
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混和液的比热容 C=4.18J/(g·℃)则该反应的中和热为△H=_______________________________;
(5)若用等浓度的醋酸代替盐酸与NaOH溶液反应,则测得的中和热的数值会 (填偏高、偏低或不变),其原因 ;
w.w.^w.k.&s.5*
34.(7分)下表列出了前20号元素中的某些元素性质的有关数据:
|
元素编号w.w.^w.k.&s.5* 元素性质 |
① w.w.^w.k.&s.5*u.c.#o |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
|
原子半径(10-10m) |
1.52 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
0.71 |
|
最高价态 |
+1 |
+1 |
-- |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
-- |
|
最低价态 |
-- |
-- |
-2 |
-- |
-4 |
-3 |
-1 |
-- |
-3 |
-1 |
试回答下列问题(注:所有非金属元素均有负价):
(1) 以上10种元素的原子中,最易失去电子的是 __(填写编号)。
(2) 上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式)___________________,固态时形成 晶体
(3)某元素R的原子半径为1.02×10-10m,该元素在周期表中位于___________ ___
(4)若物质Na2R3是一种含有非极性共价键的离子化合物,请写出该化合物的电子式_________________________,属于 晶体
33、(10分)有X、Y、Z三种常见元素,已知:①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;②Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色。请回答:
⑴Y的最高价氧化物对应水化物的化学式是 。w.w.^w.k.&s.5*
⑵将ZY3溶液滴入沸水可得红褐色液体,
反应的离子方程式是 ,
此液体具有的性质是 (填写序号字母)。
a.光束通过该液体时形成光亮的“通路” w.w.^w.k.&s.5*
b.插入电极通直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生w.w.^w.k.&s.5*
d.将该液体加热、蒸干、灼烧后,有氧化物生成
⑶X单质在空气中燃烧生成一种无色有刺激性气味的气体。
①已知一定条件下,每1mol该气体被O2氧化放热98.0kJ。若2mol 该气体与1mol O2在此条件下发生反应,达到平衡时放出的热量是176.4kJ,则该气体的转化率为 。
②该无色有刺激性气味的气体与含1.5molY的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,写出该反应的化学方程式,并用单线桥标出电子转移的方向和数目
。
32.(11分)(1)Na3N与水作用可发生水解反应,并产生气体,填空回答下列问题:
①写出Na3N的电子式:______________________ 属于 晶体。
②Na+与N3-的微粒半径关系是Na+__________N3-(填“>”、“=”、“<”)
③写出Na3N与水反应的化学方程式:_________________ ___,
产生的气体是含 键的 分子(填极性、非极性),固态时形成 晶体。
(2)有三种固态物质,它们的性质如下:
A物质:无色晶体,熔点3550℃,不导电,质硬,难溶于水及有机溶剂。
B物质:无色晶体,溶于水,质硬而脆,熔点800℃,熔化时能导电。
C物质:熔点-56.6℃,微溶于水,硬度小,固态或液态时不导电。
根据上述性质,可推断它们晶体类型为:A为_____晶体,B为_____晶体,C为____晶体。
31、(5分)A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水。根据以上信息回答下列问题:
(1)A和D氢化物中,沸点较低的是 (选填“A”或“D”);A和B的离子中,半径较小的是 (填离子符号)
(2)元素C的单质与B的最高价氧化物的水化物反应离子方程式为
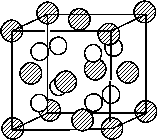
 (3)A和E可组成离子化合物,其晶胞(晶胞是在
(3)A和E可组成离子化合物,其晶胞(晶胞是在
晶体中具有代表性的最小重复单元)结构如下图所
 示,阳离子(用“ ”表示)位于该正方体的顶点或
示,阳离子(用“ ”表示)位于该正方体的顶点或
 面心;阴离子(用“ ”表示)均位于小正方体中心。
面心;阴离子(用“ ”表示)均位于小正方体中心。
该化合物的化学式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com