
16.(12分)依据氧化还原反应:2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:
(1)电极X的材料是________;电解质溶液Y是___________;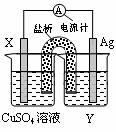
(2)银电极为电池的________极,
发生的电极反应为______________________________;
X电极上发生的电极反应为____________________________;
(3)外电路中的电子是从_______电极流向________电极。
15.(10分)工业上制备BaCl2的工艺流程图如下:
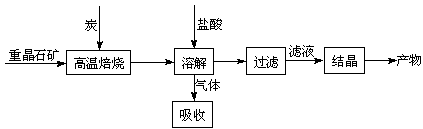
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s) + 4C(s) 4CO(g)
+ BaS(s) △H1 =
571.2 kJ·mol-1 ①
4CO(g)
+ BaS(s) △H1 =
571.2 kJ·mol-1 ①
BaSO4(s) + 2C(s) 2CO2(g)
+ BaS(s) △H2=
226.2 kJ·mol-1 ②
2CO2(g)
+ BaS(s) △H2=
226.2 kJ·mol-1 ②
⑴气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为
。 (2)反应C(s) + CO2(g) 2CO(g)的△H2= kJ·mol-1。
2CO(g)的△H2= kJ·mol-1。
(3)“温室效应”是全球关注的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
①下列措施中,有利于降低大气中CO2浓度的有: 。(填字母)
a.减少化石燃料的使用 b.植树造林,增大植被面积
c.采用节能技术 d.利用太阳能、风能
②将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
a.6CO2
+ 6H2O C6H12O6 b.CO2 +
3H2
C6H12O6 b.CO2 +
3H2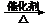 CH3OH
+H2O
CH3OH
+H2O
c.CO2 + CH4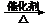 CH3COOH
d.2CO2
+ 6H2
CH3COOH
d.2CO2
+ 6H2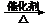 CH2==CH2
+ 4H2O
CH2==CH2
+ 4H2O
以上反应中,最节能的是 ,原子利用率最高的是 。
14.对于常温下pH为1的硝酸溶液,下列叙述正确的是
A.该溶液1mL稀释至100mL后,pH等于3
B.向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和
C.该溶液中硝酸电离出的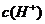 与水电离出的
与水电离出的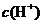 之比值为
之比值为 。
。
D.该溶液中水电离出的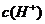 是pH为3的硝酸中水电离出的
是pH为3的硝酸中水电离出的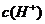 的100倍
的100倍
非选择题
13、用0.10 mol·L-1的盐酸滴定0.10 mol·L-1的氨水,滴定过程中不可能出现的结果是
A.c(NH4+)>c(Cl-),c(OH-)>c(H+)
B.c(NH4+)=c(Cl-),c(OH-)=c(H+)
C.c(Cl-)> c(NH4+), c(OH-)>c(H+)
D.c(Cl-)> c(NH4+),c(H+)> c(OH-)
12.茫茫黑夜中,航标灯为航海员指明了方向。航标灯的电源必须长效、稳定。我国科技工作者研制出以铝合金、Pt-Fe合金网为电极材料的海水电池。在这种电池中
①铝合金是阳极 ②铝合金是负极
③海水是电解液 ④铝合金电极发生还原反应
A.②③ B.②④
C.①② D.①④
11.在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
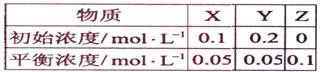
下列说法错误的是:
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
10. 25 ℃时,浓度均为0.2 mol/L的NaHCO3和Na2CO3溶液中,下列判断不正确的是
A. 均存在电离平衡和水解平衡
B. 存在的粒子种类相同
C. c(OH-)前者大于后者
D. 分别加入NaOH固体,恢复到原温度,c(CO33-)均增大
9.在一密闭容器中,aA(g) bB(g)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则
bB(g)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则
A.平衡向正反应方向移动了 B.物质A的转化率减小了
C.物质B的质量分数增大了 D. a>b
8.
2SO2(g)+O2(g)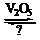 2SO3(g)是制备硫酸的重要反应。下列叙述正确的是
2SO3(g)是制备硫酸的重要反应。下列叙述正确的是
A.催化剂V2O5不改变该反应的逆反应速率
B.增大反应体系的压强,反应速率一定增大
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,SO3(g)的浓度分别是c1,c2,则时间间隔t1-t2内,SO3(g)生成的平均速率为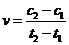
7. 25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是
A.2H+(aq) +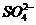 (aq)+
(aq)+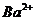 (aq)+2OH
(aq)+2OH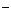 (aq)=BaSO4(s)+2H
(aq)=BaSO4(s)+2H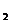 O(1);
O(1);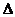 H=
H=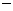 57.3
kJ/mol
57.3
kJ/mol
B.KOH(aq)+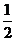 H
H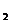 SO4(aq)=
SO4(aq)=
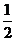 K
K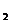 SO4(aq)+H
SO4(aq)+H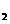 O(I);
O(I);
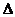 H=
H=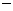 57.3kJ/mol
57.3kJ/mol
C.C8H18(I)+ 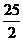 O
O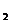 (g)=8CO
(g)=8CO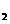 (g)+
9H
(g)+
9H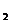 O(g);
O(g);
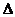 H=
H=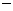 5518
kJ/mol
5518
kJ/mol
D.2C8H18(g)+25O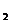 (g)=16CO
(g)=16CO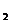 (g)+18H
(g)+18H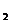 O(1);
O(1);
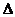 H=
H=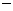 5518
kJ/mol
5518
kJ/mol
不定项选择题:本题包括7小题,每小题4分,共计28分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com