
1.(2009·苏州市高三调研)下列有关比较中,大小顺序排列正确的是 ( )
A.热稳定性:PH3>H2S>HBr>NH3
B.离子半径:Ca2+>K+>Cl->S2-
C.物质沸点:碘化氢>溴化氢>氯化氢>氟化氢
D.物质酸性:盐酸>乙酸>碳酸>苯酚
[解析] A项中非金属性越强,氢化物热稳定性就越好,比如NH3>H2S>PH3,A项错误;B项中离子电子层结构相同时,质子数越大,离子半径越小,正确的顺序应该是S2->Cl->K+>Ca2+;C项中由于氟化氢分子间存在着氢键,所以沸点应该最高。D项正确。
[答案] D
20.(2009·宁夏)已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为________,该元素的符号是________;
(2)Y元素原子的价层电子的轨道表示式为________,该元素的名称是________;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为________;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是________;
(5)比较X的氢化物与同族第二、三周期元素所形成的氢化物稳定性、沸点高低并说明理由____________。
[解析] X元素原子基态电子排布式为
1s22s22p63s23p63d104s24p3,是砷元素(As),Y元素原子基态电子排布式为1s22s22p4,是氧元素(O),Z的原子序数为42-33-8=1,是氢元素(H)。
[答案] (1)1s22s22p63s23p63d104s24p3 As
(2)
|
↑↓ |
|
↑↓ |
↑ |
↑ |
氧
2s 2p
(3)三角锥形
(4)As2O3+6Zn+6H2SO4(稀)===2AsH3↑+6ZnSO4+3H2O
(5)稳定性:NH3>PH3>AsH3,因为键长越短,键能越大,化合物越稳定;沸点:NH3>AsH3>PH3,NH3可以形成分子间氢键,沸点最高;AsH3相对分子质量比PH3大,分子间作用力大,因而AsH3的沸点比PH3高
19.下表列出前20号元素中的某些元素性质的一些数据:
|
性质 |
|
|
|
|
元素 |
原子半径(10-10m) |
最高价态 |
最低价态 |
|
① |
1.02 |
+6 |
-2 |
|
② |
2.27 |
+1 |
- |
|
③ |
0.74 |
- |
-2 |
|
④ |
1.43 |
+3 |
- |
|
⑤ |
0.77 |
+4 |
-4 |
|
⑥ |
1.10 |
+5 |
-3 |
|
⑦ |
0.99 |
+7 |
-1 |
|
⑧ |
1.86 |
+1 |
- |
|
⑨ |
0.75 |
+5 |
-3 |
|
⑩ |
1.17 |
+4 |
-4 |
试回答下列问题:
(1)以上10种元素中,第一电离能最小的是________(填编号)。
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每一个原子都满足8电子稳定结构的物质可能是________(写分子式)。元素⑨和⑩形成的化合物的化学式为________,它是一种重要的结构材料,推测它应是属于________晶体;元素①的原子价电子排布式是________。
(3)①⑥⑦⑩四种元素的气态氢化物的稳定性,由大到小的顺序是______________________________(填化学式)。
(4)③和⑨两元素比较,非金属性较弱的是________(填名称),可以验证你的结论的是下列中的________(填序号)。
A.气态氢化物的挥发性和稳定性
B.单质分子中的键能
C.两元素的电负性
D.含氧酸的酸性
E.氢化物中X-H键的键长(X代表③和⑨两元素)
F.两单质在自然界的存在形式
[解析] 由题意可知,10种元素是前20号元素,根据表中数据,我们不难推出①S,②K,③O,④Al,⑤C,⑥P,⑦Cl,⑧Na,⑨N,⑩Si。
(1)在同一周期中,从第ⅠA族到第ⅦA族,元素的第一电离能逐渐增大;同一主族中,从上向下,元素的第一电离能逐渐减小,故在10种元素中,第一电离能最小的是②K。
(2)C、P、Cl中的某两种元素形成的化合物中,PCl3或CCl4分子中的每一个原子都满足8e-稳定结构;元素⑨和⑩形成的化合物Si3N4属于原子晶体;S元素的原子价电子排布式是3s23p4。
(3)元素的非金属性越强,形成气态氢化物越稳定,非金属性强弱为Cl>S>P>Si,故其氢化物稳定性为HCl>H2S>PH3>SiH4。
(4)氧元素和氮元素相比,非金属性较弱的是氮元素,可通过C、E验证。
[答案] (1)② (2)PCl3、CCl4 Si3N4 原子 3s23p4
(3)HCl>H2S>PH3>SiH4
(4)氮元素 CE
18.下表为周期表的一部分,其中的编号代表对应的元素。
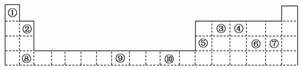
请回答下列问题:
(1)表中属于d区的元素是________(填编号)。
(2)写出元素⑨的基态原子的电子排布式________。
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的成对电子为________对。
(4)元素④的氢化物的分子构型为________,中心原子的杂化形式为________。
(5)第三周期8种元素按单质熔点高低的顺序如下图,其中序号“8”代表________(填元素符号);其中电负性最大的是________(填图中的序号)。
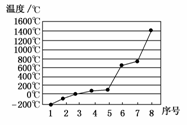
[答案] (1)⑨ (2)1s22s22p63s23p64s2
(3)1 (4)三角锥形 sp3
(5)Si 2
17.(2009·福建福州八中高二期末)下列各原子或离子的电子排布式错误的是 ( )
A.Na+:1s22s22p6 B.F:1s22s22p5
C.O2-:1s22s22p4 D.Ar:1s22s22p63s23p6
[答案] C
16.人们常将在同一原子轨道上运动的、自旋方向相反的2个电子,称为“电子对”;将在同一原子轨道上运动的单个电子,称为“未成对电子”。以下有关主族元素原子的“未成对原子”的说法错误的是 ( )
A.核电荷数为奇数的原子,其原子轨道中一定含有“未成对电子”
B.核电荷数为偶数的原子,其原子轨道中可能不含“未成对电子”
C.核电荷数为偶数的原子,其原子轨道中可能含有“未成对电子”
D.核电荷数为奇数的原子,其原子轨道中一定不含“未成对电子”
[答案] D
15.下图是第三周期11-17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是 ( )
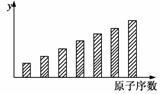
A.y轴表示的可能是电离能
B.y轴表示的可能是电负性
C.y轴表示的可能是原子半径
D.y轴表示的可能是形成基态离子转移的电子数
[答案] B
14.在d轨道中电子排布成
|
↑ |
↑ |
↑ |
↑ |
,而不能排布成
|
↑↓ |
↑↓ |
,其最直接的根据是 ( )
A.能量最低原理 B.泡利原理
C.原子轨道构造原理 D.洪特规则
[答案] D
13.下列表达方式错误的是 ( )

[答案] BC
12.如图为元素周期表的一部分。X、Y、Z、W均为短周期元素,若W原子的最外层电子数是其次外层电子数的7/8。则下列说法中正确的是 ( )
|
X |
Y |
|
|
|
Z |
W |
A.Y单质可与Z的氢化物的水溶液反应,使溶液pH升高
B.最高价氧化物的水化物酸性:W>Z
C.原子半径由大到小的排列顺序是Z>Y>X
D.X的单质中有一种为白色蜡状固体
[答案] AB
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com