
11.(2008·宿迁)下列现象与氢键有关的是 ( )
①NH3的熔、沸点比第ⅤA族其他元素氢化物的熔、沸点高
②小分子的醇、羧酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④尿素的熔、沸点比醋酸的高
⑤邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的低
⑥水分子在较高温度下也很稳定
A.①②③④⑤⑥ B.①②③④⑤
C.①②③④ D.①②③
[解析] 氢键在于电负性较大的N、O、F原子与另外含氢的分子之间,而水的稳定性与分子内的O-H共价键的强度有关。
[答案] B
10.(2007·天津理综)下列关于粒子结构的描述不正确的是 ( )
A.H2S和NH3均是价电子总数为8的极性分子
B.HS-和HCl均是含一个极性键的18电子粒子
C.CH2Cl2和CCl4均是四面体构型的非极性分子
D.1 mol DO中含中子、质子、电子各10 NA(NA代表阿伏加德罗常数)
[答案] C
9.在乙烯分子中有5个σ键和1个π键,它们分别是 ( )
A.sp2杂化轨道形成σ键,末杂化的2p轨道形成π键
B.sp2杂化轨道形成π键,未杂化的2p轨道形成σ键
C.C-H之间是sp2杂化轨道形成σ键,C-C之间是未杂化的2p轨道形成π键
D.C-C之间是sp2杂化轨道形成σ键,C-H之间是未杂化的2p轨道形成π键
[解析] 在乙烯分子中,每个碳原子的2s轨道与2个2p轨道杂化形成3个sp2杂化轨道,其中2个sp2杂化轨道分别与2个氢原子的1s轨道“头碰头”重叠形成C-H σ键,另外1个sp2杂化轨道形成C-C σ键。2个碳原子未杂化的2p轨道“肩并肩”重叠形成1个π键。
[答案] A
8.(2008·海南化学)在硼酸[B(OH)3]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构。则分子中B原子杂化轨道的类型及同层分子间的主要作用力分别是
( )
A.sp,范德华力 B.sp2,范德华力
C.sp2,氢键 D.sp3,氢键
[解析] B原子的最外层的3个电子都参与成键,故B原子中可以形成sp2杂化轨道;B(OH)3分子中的-OH可以与其他分子中的H原子形成氢键。
[答案] C
7.(2008·天津高考题)下列叙述正确的是 ( )
A.1个甘氨酸分子中存在9对共用电子对
B.PCl3和BCl3分子中所用原子的最外层都达到8电子稳定结构
C.H2S和CS2分子都是含极性键的极性分子
D.熔点由高到低的顺序是:金刚石>碳化硅>晶体硅
[解析] 甘氨酸的分子式为H2N-CH2COOH,其结构简式为 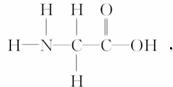 有10对共用电子对,A项不正确;BCl3分子中B最外层只有6电子,B项错误;CS2为非极性分子,C错误。
有10对共用电子对,A项不正确;BCl3分子中B最外层只有6电子,B项错误;CS2为非极性分子,C错误。
[答案] D
6.(2008·全国Ⅰ高考题)下列叙述中正确的是 ( )
A.NH3、CO、CO2都是极性分子
B.CH4、CCl4都是含有极性键的非极性分子
C.HF、HCl、HBr、HI的稳定性依次增强
D.CS2、H2O、C2H2都是直线型分子
[解析] A项CO2为非极性分子;C项中,同主族元素氢化物的稳定性自上而下依次减弱;D项中H2O为“V”型分子。
[答案] B
5.下列叙述正确的是 ( )
A.NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心
B.CCl4是非极性分子,分子中C原子处在4个Cl原子所组成的正方形的中心
C.H2O是极性分子,分子中O原子不处在2个H原子所连成的直线的中央
D.CO2是非极性分子,分子中C原子不处在2个O原子所连成的直线的中央
[答案] C
4.下列分子和离子中,中心原子价层电子对的几何构型为四面体且分子或离子空间构型为V形的是 ( )
A.NH B.PH3 C.H3O+ D.OF2
[答案] D
3.下列叙述中不正确的是 ( )
A.卤化氢分子中,卤素的非金属性越强,共价键的极性越强,分子越稳定
B.以极性键结合的分子,一定是极性分子
C.判断A2B或AB2型分子是极性分子的依据是:具有极性键且分子构型不对称、键角小于180°的非直线形结构
D.非极性分子中,各原子间都应以非极性键结合
[答案] BD
2.用杂化轨道理论解释甲烷分子的四面体结构,下列说法不正确的是 ( )
A.C原子的四个杂化轨道的能量一样
B.C原子的sp3杂化轨道之间夹角一样
C.C原子的4个价电子分别占据4个sp3杂化轨道
D.C原子有1个sp3杂化轨道由孤对电子占据
[答案] D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com