
1.(2007·海南高考)下列叙述正确的是 ( )
A.分子晶体中的每个分子内一定含有共价键
B.原子晶体中的相邻原子间只存在非极性共价键
C.离子晶体中可能含有共价键
D.金属晶体的熔点和沸点都很高
[答案] C
20.(2008·海南化学)四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数之比为4?1,其d轨道中的电子数与最外层电子数之比为5?1。
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,它们的分子式分别是________、________;杂化轨道分别是________、________;a分子的立体结构是________;
(2)X的氧化物与Y的氧化物中,分子极性较小的是(填分子式)________;
(3)Y与Z比较,电负性较大的是(填元素符号)________;
(4)W的元素符号是________,其+2价离子的核外电子排布式是________。
[解析] 由Y原子的L层p轨道中有2个电子,可推出Y为C;由Z与Y原子的价层电子数相同,可知Z为14Si或32Ge;再由W原子的L层电子数与最外层电子数之比为4?1,其d轨道中的电子数与最外层电子数之比为5?1,且只能位于第4周期等条件能得出W的电子排布式为1s22s22p63s23p63d104s2,故为30Zn。而X、Y、Z、W的核电荷数之和为51,所以Z只能是14Si、X只能是1H。最后根据价层电子对互斥模型得出它们的构型及对应的杂化类型。
[答案] (1)CH4 SiH4 sp3 sp3 正四面体
(2)CO2 (3)C
(4)Zn 1s22s22p63s23p63d10
19.(2009·福建)Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布msnmpn
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)Z2+的核外电子排布式是__________________________________。
(2)在[Z(NH3)4]2+离子中,Z2+的空轨道接受NH3分子提供的________形成配位键。
(3)Q和Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是________。
a.稳定性:甲>乙,沸点:甲>乙
b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙
d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、Y三种元素的第一电离能数值由小到大的顺序为________(用元素符号作答)。
(5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为________。
(6)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于________(填晶体类型)。
[解析] 由①知Z为Cu,由②推测Y为第三周期元素,价电子为3s23p2的为Si。由④,因原子序数按Q、R、X、Y、Z递增,故Q、X原子p轨道的电子数分别为2和4,只能为L层的p轨道,二者分别为C、O,则R只能为ⅤA族元素。
[答案] (1)1s22s22p63s23p63d9
(2)孤对电子(孤电子对) (3)b
(4)Si<C<N (5)3?2 (6)原子晶体
18.有四组物质,它们的沸点(℃,p=1.01×105 Pa下)如下表所示:
|
① |
He -268.8 |
Ne -249.5 |
Ar(x) |
Kr -151.7 |
|
② |
F2 -187.0 |
Cl2 -33.6 |
(a) 58.7 |
I2
184.0 |
|
③ |
HF(y) |
HCl -84.0 |
HBr -67.0 |
HI -35.3 |
|
④ |
H2O(z) |
H2S -60.2 |
(b) -42.0 |
H2Te -1.8 |
试根据上表回答下列问题:
(1)a为________色液体;b的分子式为________。
(2)写出②系列中物质主要化学性质的递变规律(任写一种)__________________;能够说明该递变规律的化学事实是:__________________________________(任举一例,用离子方程式表示)。
(3)除极少数情况外,上述四个系列中物质的沸点与相对分子质量之间均存在一定的关系,该关系是_________________________________
________________________________________________________________________。
(4)上表中,________和________两种物质的沸点较同系列其他物质反常,反常的主要原因是_________________________________________________________________。
[解析] 分析表中有关数据知,①为稀有气体;②为卤素单质;③为卤化氢;④为氧族元素氢化物,其中①、②沸点由分子的相对分子质量决定。③、④中HF、H2O因存在分子间氢键使沸点反常。
[答案] (1)红棕 H2Se
(2)氧化性逐渐减弱 Cl2+2Br-===2Cl-+Br2(其他合理答案也可)
(3)随着相对分子质量增大,沸点逐渐升高
(4)HF H2O 分子之间易形成氢键
17.氢元素能与许多元素化合形成化合物。下图中,“●”代表原子序数在1到10之间的原子实(原子实是原子除去价电子后剩余的部分),小黑点“·”代表未成键价电子,短线代表一个化学键(如H2O表示为 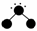 )。
)。
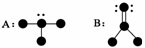
(1)写出A、B两种分子的化学式。
(2)判断A、B化合物的分子中各有多少个共价键,是极性键还是非极性键。
(3)判断A、B化合物的分子中各有多少个σ键、π键。
[答案] (1)A:NH3,B:CH2O。
(2)A(NH3)中有3个共价键,都是极性键;B(CH2O)中有4个共价键,都是极性键。
(3)A(NH3)中有3个σ键,无π键;B(CH2O)中有3个σ键,1个π键。
16.下列过程与配合物的形成无关的是 ( )
A.除去Fe粉中的SiO2可用强碱溶液
B.向一定量的AgNO3溶液中加入氨水至沉淀消失
C.向Fe3+溶液中加入KSCN溶液
D.向一定量的CuSO4溶液中加入氨水至沉淀消失
[解析] 对于A项,除去Fe粉中的SiO2是利用SiO2可与强碱反应的化学性质,与配合物的形成无关;对于B项,AgNO3与氨水反应先生成AgOH沉淀,再生成[Ag(NH3)2]+;对于C项,Fe3+与KSCN反应生成[Fe(SCN)n]3-n;对于D项,CuSO4与氨水反应先生成Cu(OH)2沉淀,再生成[Cu(NH3)4]2+。
[答案] A
15.氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为 ( )
A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化
B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成四个杂化轨道
C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强
D.氨气分子是极性分子而甲烷是非极性分子
[解析] NH3、CH4都采用sp3杂化形成,二者不同在于NH3杂化后的四个轨道中有三个成键,而有一个容纳孤对电子,CH4杂化后的四个轨道全部用于成键,这样会导致二者的空间构型有所不同。
[答案] C
14.(2009·辽宁省沈阳市2009届高三第三次模拟)现代无机化学对硫-氮化合物的研究是最为活跃的领域之一。其中如图所示是已经合成的最著名的硫-氮化合物的分子结构。下列说法正确的是 ( )
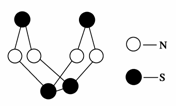
A.该物质的分子式为SN
B.该物质的分子中既有极性键又有非极性键
C.该物质具有很高的熔沸点
D.该物质与化合物S2N2互为同素异形体
[解析] 该物质的分子式为S4N4,A项错误;该分子结构中存在N-S和S-S键,故B项正确;分子晶体的熔沸点很低,C项错误;同素异形体的研究对象是单质,D项错误。
[答案] B
13.三氯化磷分子的空间构型是三角锥形而不是平面正三角形,下列关于三氯化磷分子空间构型的叙述,不正确的是 ( )
A.PCl3分子中的三个共价键的键长、键角都相等
B.PCl3分子中的P-Cl键属于极性共价键
C.PCl3分子中三个共价键键能、键角均相等
D.PCl3是非极性分子
[解析] 由PCl3电子式?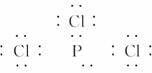 ?其结构类似于NH3为三角锥形,属于极性分子。
?其结构类似于NH3为三角锥形,属于极性分子。
[答案] D
12.氨气溶于水时,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子。根据氨水的性质可推知NH3·H2O的结构式为 ( )
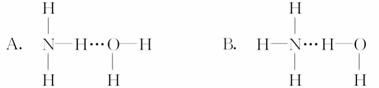
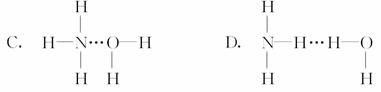
[解析] 依据NH3·H2ONH+OH-说明NH3中的N原子与H2O中H原子间形成氢键。
[答案] B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com