
11.石墨能与熔融金属钾作用,形成石墨间隙化合物,K原子填充在石墨各层碳原子中。比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写成CxK,其平面图形见下图,则x值为 ( )
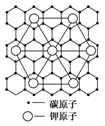
A.8 B.12 C.24 D.60
[解析] 以三个钾原子形成的小三角形为计算单位;其完全占有的碳原子数为4;占有的钾原子为×3=,故原子与钾原子个数比为8?1。
[答案] A
10.下列说法正确的是 ( )
A.二氧化碳分子中存在共价键和分子间作用力
B.甲烷、氨和水都是由极性键结合而成的极性分子
C.同主族不同元素的最高价氧化物,一定具有相同的晶体结构
D.氟化氢的沸点高于氯化氢的沸点,正丁烷的沸点高于异丁烷的沸点
[解析] 分子间作用力存在于分子间,CH4属非极性分子,CO2、SiO2的晶体类型不同。
[答案] D
9.共价键、离子键和范德华力都是粒子之间的不同作用力,下列物质同时含有上述两种作用力的组合是 ( )
①Na2O2 ②SiO2 ③石墨 ④金刚石 ⑤NaCl ⑥白磷
A.①②④ B.①③⑥
C.②④⑥ D.③④⑤
[解析] Na2O2中Na+与O之间以离子键结合,O中O-O以共价键结合,符合条件;石墨中每一层内以碳碳键结合,层与层之间以分子间作用力结合,符合条件;白磷(P4)分子内P-P以共价键结合,而P4分子之间以分子间力结合,也符合题意;SiO2、金刚石只有共价键,为原子晶体,NaCl中只有离子键。
[答案] B
8.下列各组物质的晶体中,化学键类型相同,晶体类型也相同的是 ( )
A.SiO2和SO2 B.CO2和H2O
C.NaCl和HCl D.CCl4和KCl
[解析] SiO2是共价键形成的原子晶体,SO2是共价键形成的分子晶体,A错;CO2和H2O均为共价键,而且是分子晶体,B对;NaCl是离子键形成的离子晶体,HCl是共价键形成的分子晶体,C错;CCl4是共价键形成的分子晶体,KCl是离子键形成的离子晶体,D错。
[答案] B
7.氮化硅(Si3N4)是一种新型的耐高温耐磨损材料,在工业上有广泛用途,它属于( )
A.原子晶体 B.分子晶体
C.金属晶体 D.离子晶体
[解析] 耐高温耐磨损说明熔点高,硬度大,因此是原子晶体。
[答案] A
6.NaF、NaI、MgO均为离子晶体,现有下表所示数据,试判断这三种化合物熔点由高到低的正确顺序为 ( )
|
物质 |
①NaF |
②NaI |
③MgO |
|
离子电荷数 |
1 |
1 |
2 |
|
键长/(10-30m) |
2.31 |
3.18 |
2.10 |
A.①>②>③ B.③>①>②
C.③>②>① D.①>②>③
[答案] B
5.下列各物质中,按熔点由高到低的顺序排列正确的是 ( )
A.CH4>SiH4>GeH4>SnH4
B.KCl>NaCl>MgCl2>MgO
C.Rb>K>Na>Li
D.石墨>金刚石>SiO2>钠
[答案] D
4.下列说法正确的是 ( )
A.原子晶体中只存在非极性共价键
B.稀有气体形成的晶体属于分子晶体
C.干冰升华时,分子内共价键会发生断裂
D.金属元素和非金属元素形成的化合物一定是离子化合物
[答案] B
3.下列说法错误的是 ( )
A.二氧化碳和二氧化硅都属于原子晶体
B.分子晶体的状态变化,只需克服分子间作用力
C.金属晶体通常具有导电、导热和良好的延展性
D.离子晶体在熔化状态下能导电
[答案] A
2.下列有关化学键与晶体结构说法正确的是 ( )
A.两种元素组成的分子中一定只有极性键
B.离子化合物的熔点一定比共价化合物的高
C.非金属元素组成的化合物一定是共价化合物
D.含有阴离子的化合物一定含有阳离子
[答案] D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com