
掌握复数的基本题型,主要是讨论复数的概念,复数相等,复数的几何表示,计算复数模,共轭复数,解复数方程等。
20.(2009·南通期中调研)铜及其合金是人类最早使用的金属材料。
(1)铜原子的核外电子排布式是________。
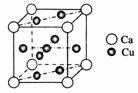
(2)铜的熔点比钙高,其原因是________;右图是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为________。
(3)Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物。
①[Cu(NH3)4]2+中存在的化学键类型有________(填序号)。
A.配位键 B.金属键
C.极性共价键 D.非极性共价键
E.离子键
②[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为________。
③某种含Cu2+的化合物可催化丙烯醇制备丙醛的反应:HOCH2CH===CH2―→CH3CH2CHO。在丙烯醇分子中发生某种方式杂化的碳原子数,是丙醛分子中发生同样方式杂化的碳原子数的2倍,则这类碳原子的杂化方式为______________。
[答案] (1)1s22s22p63s23p63d104s1
(2)晶体中铜的金属键强度大于钙 1∶5
(3)①A、C ②平面正方形 ③sp2
19.(2009·南京师大附中模拟)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
|
元 素 |
Mn |
Fe |
|
|
电离能 /kJ·mol-1 |
I1 |
717 |
759 |
|
I2 |
1509 |
1561 |
|
|
I3 |
3248 |
2957 |
回答下列问题:
(1)Mn元素价电子层的电子排布式为________,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。对此,你的解释是___________________。
(2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是________。
②六氰合亚铁离子[Fe(CN)]中的配体CN-中C原子的杂化轨道类型是________,写出一种与CN-互为等电子体的单质分子的路易斯结构式______。
(3)三氯化铁常温下为固体,熔点282 ℃,沸点315 ℃,在300 ℃以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为________。
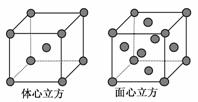
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为________。
[答案] (1)3d54s2 由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转变为不稳定的3d4状态
(2)①具有孤对电子 ②sp ?N≡N?
(3)分子晶体 (4)2?1
18.(2009·广东模拟)有A、B、C、D四种元素,A元素原子的所有能级具有相同的电子数,由B元素形成的单质在常温常压为易挥发的液体,可从海水中提取,C的外围电子构型为3d104s1。D位于A的下一个周期,是构成地球上矿物界的主要元素。
请回答下列问题:
(1)元素A能形成多种单质,其中的一种单质能用做电极、润滑剂与制造铅笔等。A与D所形成的化合物属于________晶体,其中心原子是以________形式杂化成键;
(2)B的核外电子排布式为__________________________________;
(3)向含有C的硫酸盐中逐滴滴加氨水,所观察到的现象是_____________________;
(4)A的氢化物与D的氢化物相比,熔点高的是________(填化学式),理由是________________________________________________________________________。
(5)下列说法中正确的是________。
a.晶体析出规则是晶格能高的晶体最后析出
b.钾型与铜型都是密置层堆积方式
c.在干冰晶体中,每一个CO2周围有12个紧邻的CO2分子
d.邻羟基苯甲醛的沸点比对羟基苯甲醛的沸点要高
[解析] (1)A元素原子的所有能级具有相同的电子数,说明A可能为1s22s2或1s22s22p2,结合A单质的用途可知A为碳,D位于A的下一个周期,是构成地球上矿物界的主要元素,说明D为硅。碳与硅形成的化合物为SiC,是原子晶体,中心原子是以sp3形式杂化成键。
(2)在常温常压下呈液态的单质有Br2或Hg,能从海水中提取的是前者。
(3)C为Cu,在硫酸铜溶液中逐滴滴加氨水,首先会出现蓝色沉淀,后蓝色沉淀溶解,形成深蓝色的溶液。
(4)CH4与SiH4相比,后者的熔点要高,可以从范德华力的相对强弱来解释。
(5)晶格能越高,其熔点就会越高,因此越容易析出;钾型是非密置层堆积方式,而铜型、镁型才是密置层堆积方式;邻羟基苯甲醛只能形成分子内氢键,对羟基苯甲醛形成的是分子间氢键,故前者的沸点比后者的要低。
[答案] (1)原子 sp3
(2)[Ar]3d104s24p5或1s22s22p63s23p63d104s24p5
(3)开始有蓝色沉淀生成,随着氨水的滴入,沉淀的量逐渐增加至最多后开始溶解,最后蓝色沉淀完全消失,形成深蓝色的透明溶液
(4)SiH4 CH4与SiH4是组成与结构相似的物质,而CH4比SiH4的相对分子质量要小,分子间的作用力要小,所以熔点要低
(5)c
[解析] (1)短周期元素中,原子最外层电子和电子层数相等的元素有H、Be、Al三种元素。
(2)根据表提供的数据及其余元素形成氢化物的性质特点可知,A为LiH,B为H2O,C为HF,D为NH3,E为CH4。图Ⅰ所给的数据为第三周期元素单质的熔点,在第三周期中,晶体硅是原子晶体,其熔点最高,故h为Si。
(3)H元素与第二周期元素形成的氢化物有CH4、NH3、HF、H2O,图Ⅱ为正四面体结构,可见乙为NH,能与NH反应的只有H2O:NH+H2ONH3·H2O+H+。
(4)根据题意可推出丙为金刚石,丁为二氧化硅,二者在高温下发生如下置换反应:2C+SiO2Si+2CO↑,根据金刚石的结构,可知每1个C原子以4个共价键与其他4个C原子相连,根据均摊法可知每1个C原子分得的共价键数目为2。在反应中金刚石被破坏了1 mol共价键,则参与反应的C为0.5 mol,SiO2为0.25 mol,即SiO2的质量为15 g。
[答案] (1)3 (2)HF Si
(3)NH+H2ONH3·H2O+H+ (4)15
17.(2009·山东)C和Si元素在化学中占有极其重要的地位。
(1)写出Si的基态原子核外电子排布式________。
从电负性角度分析,C、Si和O元素的非金属活泼性由强到弱的顺序为________。
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为________,微粒间存在的作用力是________。
(3)氧化物MO的电子总数与SiC的相等,则M为________(填元素符号)。MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是__________________________________。
(4)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同。CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π键。从原子半径大小的角度分析,为何C、O原子间能形成、而Si、O原子间不能形成上述π键。
[解析] (1)Si原子核外有14个电子,电子排布式为1s22s22p63s23p2,电负性:O>C>Si,则非金属性O>C>Si。
(2)晶体硅中键角为109°28′,sp3杂化,SiC属原子晶体,原子间以共价键结合。
(3)SiC的电子总数为20,则M为Mg。MgO与CaO相比,r(Mg2+)比r(Ca2+)小,离子键强(晶格能大)。
[答案] (1)1s22s22p63s23p2 O>C>Si
(2)sp3 共价键
(3)Mg Mg2+半径比Ca2+小,MgO晶格能大
(4)C的原子半径较小,C、O原子能充分接近,p-p轨道肩并肩重叠程度较大,形成较稳定的π键;Si的原子半径较大,Si、O原子间距离较大,p-p轨道肩并肩重叠程度较小,不能形成上述稳定的π键。
16.元素周期表反映了元素性质的周期性变化规律。请根据短周期元素在周期表中的位置、结构和相关性质,回答下列问题:
(1)短周期元素中,原子最外层电子数和电子层数相等的元素有________种。
(2)第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如下表所示,其中C的化学式为________;第三周期元素单质的熔点(℃)变化如下图I所示,其中h的元素符号为________。
|
氢化物 |
沸点/℃ |
|
A |
1317 |
|
B |
100 |
|
C |
19.5 |
|
D |
-33 |
|
E |
-162 |
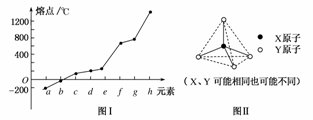
(3)原子半径最小的元素与第二周期的两种元素可分别形成分子甲和离子乙。分子甲和离子乙含有相等的电子数,且乙的立体结构如图Ⅱ所示。请写出甲、乙反应的离子方程式________________________________________。
15.媒体曾报道硼和镁形成的化合物刷新了金属化合物超导的最高纪录。如图示意的是该化合物的晶体结构:镁原子间形成正六棱柱,且棱柱的上下底面还各有一个镁原子;6个硼原子位于棱柱侧面上。则该化合物的化学式为 ( )
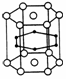
硼镁化合物结构
A.MgB2 B.Mg3B2
C.Mg2B D.Mg2B3
[答案] A
14.据权威刊物报道,科学家在宇宙中发现H3分子。甲、乙、丙、丁四位学生对此报道的认识正确的是 ( )
A.甲认为上述发现绝对不可能,因为H3分子违背了共价键理论
B.乙认为宇宙中还可能存在另一种氢单质,因为氢元素有三种同位素必然有三种同素异形体
C.丙认为H3分子实质上是H2分子与H+以特殊共价键结合的产物,应写成H
D.丁认为如果上述的发现存在,则证明传统的价键理论有一定的局限性,有待继续发展
[答案] D
13.(2009·吉林七校联考)元素A和B的原子序数都小于18。已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M层电子数为(a-b),L层电子数为(a+b),则A、B两元素所形成的化合物的晶体类型为 ( )
A.原子晶体 B.分子晶体
C.离子晶体 D.金属晶体
[答案] A
12.二氧化硅晶体是空间网状结构,如图所示。关于二氧化硅晶体的下列说法中,不正确的是 ( )
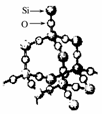
A.1 mol SiO2晶体中Si-O键为2 mol
B.晶体中Si、O原子个数比为1?2
C.晶体中Si、O原子最外电子层都满足8电子结构
D.晶体中最小环上的原子数为8
[答案] AD
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com