
23.(14分)现有6种短周期元素的性质或原子结构如下表:
|
元素编号 |
元素性质或原子结构 |
|
W |
周期表中原子半径最小的元素 |
|
U |
地壳中含量最多的金属元素 |
|
R |
单质为空气的主要成分 |
|
T |
M层上有6个电子 |
|
X |
最外层电子数是次外层电子数的2倍 |
|
Y |
氢化物水溶液呈碱性 |
|
Z |
元素最高正价是+7价 |
完成下列空白(涉及W、U、R、T、X、Y、Z时,用元素符号表示):
(1)元素T的原子共有 个电子;元素X的一种核素可测定文物年代,这种核素的符号是 。
(2)用电子式表示:
①气态化合物XR2_________________;
②元素W、R形成的10电子分子的形成过程______________________________。
(3)用离子方程式表示:
①元素Y与元素W形成的离子YW4+与NaOH溶液共热的反应 _____;
②元素U的单质与NaOH溶液反应_______________________________________。
(4)元素Z与元素T相比,非金属性较强的是 ,下列表述中能证明这一事实的
是 (填序号)。
a. 常温下Z的单质和T的单质状态不同
b. Z的氢化物比T的氢化物稳定
c. 一定条件下Z和T的单质都能与氢氧化钠溶液反应
(5)探寻物质的性质差异性是学习的重要方法之一。在T、X、Y、Z四种元素的最高价氧化物的水化物中,化学性质明显不同于其他三种的是 (用分子式表示),理由是 。
22.(7分)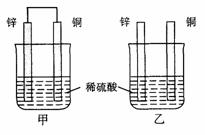 将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答
将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答
下列问题:
(1)下列说法正确的是____________。
A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少
D.两烧杯中溶液的pH均增大
(2)在相同时间内,两烧杯中产生气泡的速度:甲____乙(填“>”、“<“或“=”)。
(3)当甲中产生1.12L(标准状况)气体时,通过导线的电子数目为_______________。
(4)当乙中产生1.12L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol·L-1(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为_________________。
21.(10分)填写下列空白:
(1)表示含有17个质子、20个中子的原子的化学符号是___________________。
(2)第三周期0族元素的原子结构示意图为_______________。
(3)周期表中被称为第Ⅷ族的元素位于第_____________________纵行。
(4)周期表中最活泼的非金属元素位于第__________周期、第_________族。
(5)所含元素超过18种的周期是第__________、_________周期。
20.下图是周期表中短周期的一部分,若a原子最外层电子数比
 次外层少了3个,则下列说法不正确的是
次外层少了3个,则下列说法不正确的是
A.a与c不能形成化合物
B.氢化物比的稳定性:d>b
C.原子半经的大小顺序是:c>b>a>d
D.a、b、c的最高价氧化物对应水化物的酸性强弱的关系是:c>b>a
19.木炭与浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量
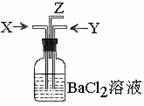 氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是
氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是
A.洗气瓶中产生的沉淀是碳酸钡
B.Z导管出来的气体中无二氧化碳
C.洗气瓶中产生的沉淀是硫酸钡
D.Z导管口附近可能观察到红棕色出现
18.下列各组物质中,化学键类型完全相同的是
A.N2和NaOH B.CO2和H2O C.MgO和NaCl D.HCl和KCl
17.下列各组物质的性质依次递减的是
A.碱性:Al(OH)3、Mg(OH)2、NaOH B.还原性:HI、HBr、HCl
C.酸性:HClO4、H2SO4、H3PO4 D.稳定性:H2CO3、NaHCO3、Na2CO3
16.可逆反应N2+3H2 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表
示,下列各关系中能说明反应已达到平衡状态的是
A.3v正(N2)=v正(H2) B.2v正(N2)=v逆(NH3)
C.v正(N2)=3v逆(H2) D.2v正(H2)=3v逆(NH3)
15.哈伯因发明用氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭
容器中充入1molN2和3 molH2,在一定条件下使该反应发生。下列说法正确的是
A.达到化学平衡时,N2完全转化为NH3
B.一定条件下达到化学平衡后,反应体系中的压强保持不变
C.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
D.达到化学平衡时,正反应和逆反应速率都为零
14.用铜、银和硝酸银溶液设计一个原电池,下列对该原电池的判断正确的是
A.铜作负极被氧化 B.银为正极被还原
C.正极反应为:Ag+ + e-=Ag D.NO3-向正极移动
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com