
12. 环境监测测定水中溶解氧的方法是:
(1)准确量取amL水样,置于洁净干燥的带塞锥形瓶中,迅速加固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好塞子并振荡摇匀,使之充分反应:
 (该反应极快)
(该反应极快)
(2)测定:开塞后迅速加入适量硫酸使锥形瓶内发生如下反应:
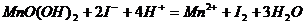 。向锥形瓶中加入少许指示剂淀粉试液,用滴定管中的浓度为bmol/L的Na2S2O3溶液滴定到终点时,共消耗VmL的Na2S2O3溶液。其反应式为:I2+2S2O32-=2I-+S4O62-
。向锥形瓶中加入少许指示剂淀粉试液,用滴定管中的浓度为bmol/L的Na2S2O3溶液滴定到终点时,共消耗VmL的Na2S2O3溶液。其反应式为:I2+2S2O32-=2I-+S4O62-
试回答:① 准确量取amL水样的仪器是____。② 滴定到终点时,溶液由____色变成____。③ 水中溶解氧气的量(以g/L为单位)的计算式为____。④ 测定时,滴定管经水洗、蒸馏水洗后,加滴定剂Na2S2O3溶液,然后滴定,这样会导致测定结果____(偏低、偏高、无影响)。
11. 实验室有一瓶可能含有NaCl,Na2SO4、KNO3、K2CO3、K2SO4中的一种或几种杂质的亚硫酸钠,通过下列实验以确定其成分及其质量分数,试根据实验填写以下空白:
称取样品6.30g,加入6.0mol/L的硫酸至过量,产生无色气体560mL(标准状况);向逸出气体后的溶液中加入稍过量的BaCl2溶液得白色沉淀9.32g,溶液的焰色反应仅呈黄色。

(1)若用下列仪器进行上述气体的发生、净化,并测定其体积的系列实验,气体流向从左到右,各仪器的正确连接顺序是(用A、B、C、D……填写)____接____,____接____,____接____。X是____,汽油的作用是____。
(2)操作时,怎样操作才能正确地测出反应放出的气体体积?
(3)若实验中加入硫酸溶液为5.00mL,则亚硫酸钠的质量分数为____.一定含有的杂质是____,不能确定的是____。
10. 有A、B、C、D四瓶未知溶液,它们是Na2CO3、K2SO4、KHSO4和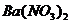 ,为了鉴别它们,进行了下列实验。
,为了鉴别它们,进行了下列实验。
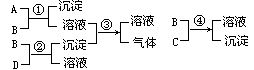
由此可以判断:A是____,B是____,C是____,D是____。
9. 实验室可用图的装置将二氧化碳和一氧化碳进行分离和干燥.已知a、b均为活塞,试回答:
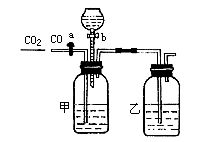
(1)甲瓶中装的是____溶液,乙瓶中装的是____,分液漏斗中装的是____。
(2)当CO2与CO的混合气体通过该装置时,先分离得到的是____,活塞操作是____,然后得到____,活塞操作是____。
8. 某学生将混有铜粉的氯化铁晶体(FeCl3·6H2O)提纯,以得到纯净的氯化铁晶体,他提出了下列实验步骤:a. 把样品溶解;b. 过滤除去铜粉;c. 蒸干溶液即到氯化铁晶体。
(1)以上实验步骤是否可行?____,其原因是什么?(要写出有关的化学方程式)____。
(2)请拟出合理的实验方案(只写简单步骤):①____、②____、③____、④____、⑤____、⑥____。
7. 某工厂排放的污水中含有Mg2+、Al3+、Hg2+、Fe3+、Cu2+等离子。甲、乙、丙三位同学设计从污水中回收金属铜的方案如下:
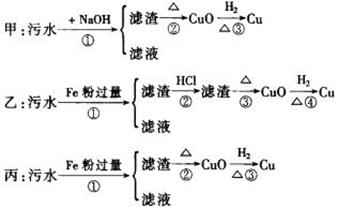
请回答:
(1)甲、乙、丙提出的实验方案能否制得铜?(填“能”或“不能”)
甲_________,乙_________,丙_________
(2)在制得铜的方案中,哪一步骤操作还会导致环境污染_________。怎样防止,采取的措施为_________。
6. 设计一套实验装置:① 制备CO(用浓H2SO4与甲酸);② 用制取的CO还原氧化铜,并证明生成物是铜和CO2;③ 多余的CO不能逸入空气中。简述步骤并写有关的化学方程式。
5. 以六水含氯化镁MgCl2·6H2O为原料制备无水氯化镁。已知MgCl2·6H2O晶体在空气中加热时,释出部分结晶水,同时生成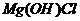 或MgO。而在干燥HCl气流中加热,能制得无水MgCl2。
或MgO。而在干燥HCl气流中加热,能制得无水MgCl2。
可选用的药品:MgCl2·6H2O 晶体、NaCl(固)、KClO3(固)、MnO2(固)、浓H2SO4、浓盐酸、稀NaOH溶液。仪器;见下图(可重复使用):
(1)组装氯化氢气体发生器,应选用的仪器(用编号A、B……填入):_____________,有关化学方程式为_____________。
(2)按HCl气流流向,其余装置的连接顺序(用数字1、2……填放)是( )→( )、( )→( )、( )→( )、( )。
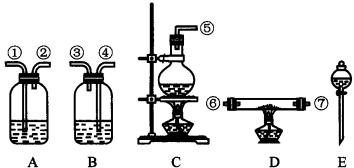
(3)各装置中应放的药品为:A_________,B_________,C_________,D_________,E_________。
(4)B装置的作用是_________。 B中能观察到的现象是_________。
4. 有一工业废水,已知其中含有大量的FeSO4和少量的Fe3+ 、Ag+ 、Na+及泥砂。试设计一个经济合理的实验方案,以回收金属银和绿矾晶体。请按下表中(1)-(6)的序号写出实验步骤。并说明各步骤的目的。
|
实验顺序 |
实验步骤内容 |
实验目的说明 |
|
(1) |
|
|
|
(2) |
|
|
|
(3) |
|
|
|
(4) |
|
|
|
(5) |
|
|
|
(6) |
|
|
3. 氯化铜(CuCl2·2H2O)中FeCl2杂质。为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示的操作步骤进行提纯。
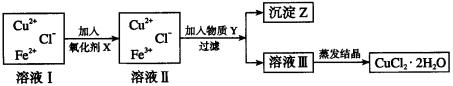
(1)加入氧化剂X的目的是_________。
(2)下列氧化剂中最适合于本实验的是_________。
A. H2O2 B. KMnO4 C. NaClO D. K2Cr2O7
(3)物质Y和沉淀Z的化学式分别是_________和_________。
(4)为分离出沉淀Z,并将溶液Ⅲ蒸发获得晶体,从A-L中选择所需的仪器为________。除以上仪器之外还需要的仪器和实验用品是_______。(已知完全呈氢氧化物沉淀所需的pH:Fe3+ 为3.7,Cu2 为6.4,Fe2+ 为6.4。)
A漏斗 B烧杯 C试管 D蒸发皿 E坩埚 F温度计 G酒精灯
H喷灯 I铁架台(附铁圈) J药匙 K滴管 L锥形瓶
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com