
19. 在通常条件下,下列各组物质的性质排列正确的是( )
A.熔点: B.水溶性:
B.水溶性: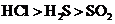
C.沸点:乙烷>戊烷>丁烷
D.热稳定性:
18. 下列叙述正确的是
A.氯化铯晶体中,每1个Cs+与其他8个Cs+等距离紧邻
B.金刚石网状结构中,由共价键构成的碳原子环中,最小的环上有4个碳原子
C.熔点由高到低的顺序是:金刚石>碳化硅>晶体硅
D.PCl3和了BCl3分子中所有原子的最外层都达到8电子稳定结构
17. 向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.沉淀溶解后,生成了深蓝色的配合离子[Cu(NH3)4] 2+
C.上述现象说明[Cu(H2O)4] 2+比[Cu(NH3)4] 2+中的配位键稳定
D.在[Cu(NH3)4] 2+离子中,Cu2+给出孤对电子,NH3提供空轨道
16.下列判断正确的是
A.酸酐一定是氧化物 B.晶体中一定存在化学键
C.碱性氧化物一定是金属氧化物 D.正四面体分子中键角一定是109o28′
15.已知X、Y是主族元素,I为电离能,单位是KJ/mol。根据下表所列数据判断错误的是
|
元素 |
I1 |
I2 |
I3 |
I4 |
|
X |
496 |
4562 |
6912 |
9543 |
|
Y |
578 |
1817 |
2745 |
11600 |
A.元素X的常见化合价是+1价 B.元素Y是ⅢA族的元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第3周期,它可与冷水剧烈反应
14.下列各组微粒属于等电子体的是
A.CO和CO2 B.NO和NO2 C.CH4和NH3 D.CO2和N2O
13.下列各组无机酸的酸性强弱比较正确的是
A. HClO>HClO2>HClO3>HClO4 B. HF<HCl<HBr<HI
C. H2CO3<H2SiO3<H2GeO3 D. HNO3<HPO3
12.下列是几种原子的基态电子排布,电负性最大的原子是
A.1s22s22p4 B.1s22s22p63s23p3 C.1s22s22p63s23p2 D.1s22s22p63s23p64s2
11.下列说法中正确的是
A.干冰升华时分子内共价键会发生断裂
B.原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性
C.分子晶体的熔沸点低,常温下均呈液态或气态
D.金属导电的原因是在外加电场的作用下金属产生自由电子,电子定向运动
10.下列说法正确的是
A.最外层电子排布为ns2的元素一定处于周期表IIA族
B.主族元素X、Y能形成 型化合物,则X与Y 的原子序数之差可能为2或5
型化合物,则X与Y 的原子序数之差可能为2或5
C.氯化氢的沸点比氟化氢的沸点高
D.同主族元素形成的氧化物的晶体类型均相同
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com