
11.元素的性质呈周期性变化的根本原因是( )
A.随着元素相对原子质量的递增,量变引起质变
B.元素的原子半径呈周期性变化
C.元素原子的核外电子排布呈周期性变化
D.元素的金属性和非金属性呈周期性变化
10.C、CH4、CO、C2H5OH是常用的燃料,它们每1 mol 分别完全燃烧生成CO2(g)及H2O(l)时,放出的热量依次为393.5kJ、890.3kJ、110.5kJ、1366.8kJ。相同质量的这4种燃料,完全燃烧时放出热量最多的是( )
A. C B. CH4 C.CO D. C2H5OH
9.100 mL 6 mol·L-1 H2SO4 跟足量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
A.碳酸钠固体 B.硝酸钠 C.硫酸钾固体 D.醋酸钠固体
8.将锌片和铜片用导线连接后放入稀硫酸溶液中发生原电池反应,下列叙述正确的是( )
A.负极附近的SO42- 浓度逐渐减小 B.正极有O2逸出
C.电子通过导线由铜片流向锌片 D.铜片上有H2逸出
7.普通干电池负极的电极反应式是( )
A.Zn-2e-=Zn2+ B.Zn2++2e-=Zn
C.4OH--4e- =O2↑+2H2O D.2H++2e- =H2↑
6.把铝条放入盛有过量稀盐酸的试管中,不影响氢气产生速率的因素是( )
A.盐酸的浓度 B.铝条的表面积
C.溶液的温度 D.加少量Na2SO4
5.下列各组物质发生状态变化所克服的微粒间的相互作用属于同种类型的是( )
A.食盐和蔗糖溶于水 B.氯化钠和硫熔化
C.碘和干冰升华 D.二氧化硅和氧化钠熔化
4.下列化学用语书写正确的是( )
A.氯原子的结构示意图: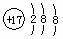
B.作为相对原子质量测定标准的碳核素: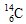
C.氯化镁的电子式: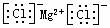
D.用电子式表示氯化氢分子的形成过程:
3.下列说法正确的是( )
A.离子化合物只能由金属元素和非金属元素组成
B.离子化合物只能存在离子键
C.盐酸能电离出氢离子和氯离子,所以HCl存在离子键
D.共价化合物中不可能存在离子键
2.下列关于物质性质的比较,正确的是 ( )
A.相同温度下,水中的溶解度:NaHCO3>Na2CO3
B.熔点:铯>钾>钠>钠和钾的合金
C.熔沸点:HI>HBr>HCl>HF
D.热稳定性:HF>HCl>HBr>HI
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com