
22.(22分) 乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
(1) CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为 ;1mol O22+中含有的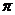 键数目为 。
键数目为 。
 (2)将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2,红棕色沉淀。Cu+基态核外电子排布式为 。
(2)将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2,红棕色沉淀。Cu+基态核外电子排布式为 。
(3)乙炔与氢氰酸反应可得丙烯腈 。丙烯腈分子中碳原子轨道杂化类型是 ;分子中处于同一直线上的原子数目最多为 。
。丙烯腈分子中碳原子轨道杂化类型是 ;分子中处于同一直线上的原子数目最多为 。
(4) CaC2晶体的晶胞结构与NaCl晶体的相似(如右图所示),但CaC2晶体中哑铃形C22-的存在,使晶胞沿一个方向拉长。CaC2晶体中1个Ca2+周围距离最近的C22-数目为 。
(5)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛高,其主要原因是 ;
甲醛分子中碳原子的轨道杂化类型为 。
②甲醛分子的空间构型是 ;
1mol甲醛分子中σ键的数目为 。
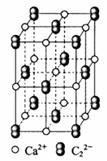
③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为 。

③ 4
21.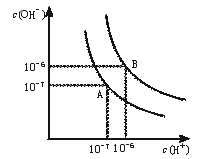 (8分)水的电离平衡曲线如下图所示。
(8分)水的电离平衡曲线如下图所示。
(1)若以A点表示25℃时水在电离平衡时的离子浓度, 当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 。
(2)将常温下的pH=8的Ba(OH)2溶液与常温下的pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为 。
(3)已知AnBm的离子积=[c(Am+)]n·[c(Bn-)]m?,式中c(Am+)n和c(Bn-)m表示离子的物质的量浓度。在某温度下,Ca(OH)2的溶解度为0.74 g,其饱和溶液密度设为1 g/mL,其离子积为 。
20.(10分)钡盐行业生产中排出大量的钡泥[主要含有BaCO3 、BaSiO3、 BaSO3、 Ba(FeO2)2等]。某主要生产BaCl2、BaCO3 、BaSO4的化工厂利用钡泥制取Ba(NO3)2,其部分工艺流程如下:
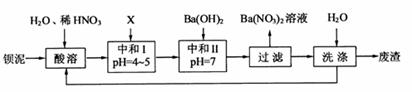
(1)酸溶后溶液中pH=1,Ba(FeO2)2与HNO3的反应化学方程式为 。
(2)酸溶时通常控制反应温度不超过70℃,且不使用浓硝酸,原因是 、 。
(3)该厂结合本厂实际,选用的X为 (填化学式);中和Ⅰ使溶液中 (填离子符号)的浓度减少(中和Ⅰ引起的溶液体积变化可忽略)。
(4)上述流程中洗涤的目的是 。
19.(14分)电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a; X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
① 电解池中X极上的电极反应式为 。在X极附近观察到的现象是 。
② Y电极上的电极反应式为 ,
检验该电极反应产物的方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
① X电极的材料是 ,电极反应式是 。
② Y电极的材料是 ,电极反应式是 。
(说明:杂质发生的电极反应不必写出)
18.(4分)用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是 。
A. 配制标准溶液的氢氧化钠中混有Na2CO3杂质
B. 滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C. 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
 E. 未用标准液润洗碱式滴定管
E. 未用标准液润洗碱式滴定管
17.(8分)有两只密闭的容器A和B,A能保持恒压,B能保持恒容。起始时向容积相等的两容器中通入体积比为2:l的等量的S02和02,使之发生反应: 2S02 +02 2S03,并达到平衡。则(填<、=、>;左、右;增大、减小、不变)
(1)达到平衡所需的时间:tA tB,S02的转化率:aA aB。
(2)起始时两容器中的反应速率:vA_______vB,反应过程中的反应速率:vA______vB
(3)达到平衡时,向两容器中分别通入等量的氩气。A容器中的化学平衡向 反应方向移动,B容器中的化学反应速率
(4)达到平衡后,向两容器中分别通入等量的原反应气体,再次达到平衡时,A容器中的S02的百分含量 ,B容器中S02的百分含量 。
16.(6分)由氢气和氧气反应生成1mol水蒸气放热241.8kJ写出该反应的热化学反应方程式: 。若1g水蒸气转化为液态水放热2.444kJ,则反应H2(g)+1/2O2(g)=H2O(g)的△H= kJ·mol-1。氢气的燃烧热为 kJ·mol-1。
15.(6分)下列10种物质中:①NaOH溶液 ②H2SO4 ③硫酸铜晶体 ④Cu ⑤CH3COOH ⑥NaOH固体 ⑦蔗糖 ⑧石灰水 ⑨水银 ⑩氨水
能导电的有 ;属于强电解质的有 ;属于弱电解质的有 。
14.在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知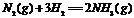 ⊿H=-92.4kJ·mol-1)
⊿H=-92.4kJ·mol-1)
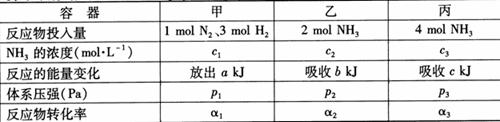
下列说法正确的是
A.  B.
B. 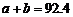 C.
C. 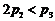 D.
D. 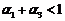
第II卷
13. 常温下,用 0.1000 mol·L-1 NaOH溶液滴定 20.00ml 0.10000 mol·L-1 CH3COOH溶液滴定曲线如右图。下列说法正确的是
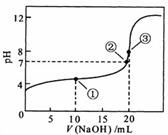 A. 点①所示溶液中:
A. 点①所示溶液中:
c(CH3COO-)+ c(OH-)= c(CH3COOH)+ c(H+)
B. 点②所示溶液中:
c(Na+)= c(CH3COOH)+ c(CH3COO-)
C. 点③所示溶液中:
c(Na+)> c(OH-)>(CH3COO-)> c(H+)
D. 滴定过程中可能出现:
c(CH3COOH)> c(CH3COO-) > c(H+)> c(Na+)> c(OH-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com