
24.氟是一种氧化性极强的非金属元素,它甚至能够和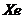 在一定压强下直接化合,生成
在一定压强下直接化合,生成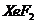 、
、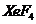 、
、 等固体,这些固体都易发生水解,水解产物中均有
等固体,这些固体都易发生水解,水解产物中均有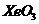 ,
,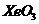 极不稳定,易转化为单质而呈强氧化性。
极不稳定,易转化为单质而呈强氧化性。
(1)配平下列离子方程式,并标出电子转移的方向和数目:
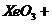
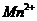 +
+ 
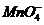 +
+
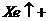
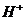
(2)反应的现象为①有气泡产生:②
(3) 发生氧化反应
(4)将适量的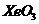 投入30ml 0.1mol/L
投入30ml 0.1mol/L 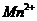 的水溶液中,刚好完全反应。
的水溶液中,刚好完全反应。
①此时转移电子 mol
②将反应以后的溶液稀释到90ml , 所得溶液的pH值=
23.下表列出了周期表前20号元素中某些元素的有关数据:
|
元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
原子半径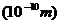 |
1.52 |
1.23 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
0.71 |
|
最高价态 |
+1 |
+1 |
- |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
- |
|
最低价态 |
- |
- |
-2 |
- |
-4 |
-3 |
-1 |
- |
-3 |
-1 |
试回答下列问题:(以下各题回答均用其体的元素符号表示)
(1)以上10种元素的原子中,失去核外第一个电子所需能量最少的是
(2)上述⑤、⑥、⑦号元素中,其中的某2种元素形成的化合物中,每一个原子都满足最
外层为8电子稳定结构的物质可能是 ;
(3)某元素R的原子半径为1.02×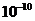 m,该元素在周期表中的位置是
m,该元素在周期表中的位置是
(4)④、⑦、⑧、⑩四种元素形成的离子,其半径由小到大的顺序为
(5)元素①和④相比较,金属性较强的是 ,能验证该结论的实验是 ;
A、比较这两种元素最高价氧化物对应水化物的碱性强弱
B、将①的单质投入④的盐溶液中,看能否置换出④的单质
C、将两种元素的单质投入到相同浓度的稀盐酸中,观察放出气体的速度
D.将等质量的相同形状的两种元素单质投入到足量的同浓度的稀盐酸中,反应完毕,观察两者产生气体的多少
22.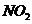 和
和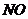 是大气的污染物,可用
是大气的污染物,可用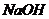 潮溶液吸收,反应式:
潮溶液吸收,反应式:
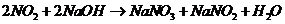
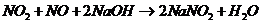
现有a升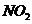 (其中还含有20%的
(其中还含有20%的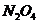 )和b升
)和b升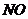 的混合气体,被200ml
的混合气体,被200ml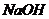 溶液完全吸收,则a/b的值可能是(气体体积均已经折算为标准状况下)
溶液完全吸收,则a/b的值可能是(气体体积均已经折算为标准状况下)
A.0.75 B.0.85 C.0.8 D.1
第II卷(共84分)
21.在150℃时,由两种气体组成的混合气体1L,在9L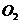 中充分燃烧(
中充分燃烧(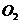 过量),恢复到反应前的温度,体积为10L,该混合气体的组成可能是
过量),恢复到反应前的温度,体积为10L,该混合气体的组成可能是
A.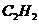 和
和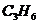 B
B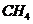 和
和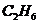 C.
C.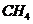 和
和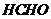 D.
D.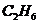 和
和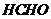
20.对于常温下pH为5的硫酸溶液,下列叙述正确的是
A.该溶液1mL稀释至1000mL后,pH等于8
B.向该溶液中加入等体积、pH为9的氢氧化钠溶液恰好完全中和
C.该溶液中硫酸电离出的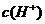 与水电离出的
与水电离出的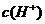 之比值为100
之比值为100
D.该溶液中加入甲基橙后,溶液为红色
19.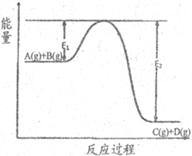 反应
反应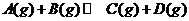 过程中的能量变化如图所示,下列说法正确的是
过程中的能量变化如图所示,下列说法正确的是
A.该反应的正反应是吸热反应
B.该反应的正反应是放热反应
C.反应体系中加入催化剂,最终能够使反应热减小
D.在反应体系中加入催化剂,反应速率增大,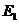 和
和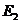 均减小
均减小
项的,多选不给分;有两个正确选项的,选对一个给2分,选错一个,该小题不给分。)
18.下列离子方程式正确的是
A.物质的量相等的溴化亚铁跟氯气反应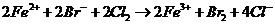
B.向硫酸亚铁溶液中通入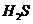 气体:
气体: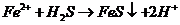
C.向烧碱溶液中滴加少量氯化铝溶液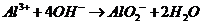
D.小苏打溶液中加入过量石灰水
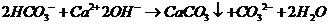
17.下列溶液中有关物质的量浓度关系正确的是
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:
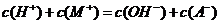
B.pH相等的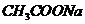 、
、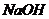 和
和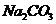 三种溶液:
三种溶液:
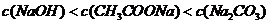
C.物质的量浓度相等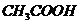 和
和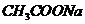 溶液等体积混合:
溶液等体积混合:
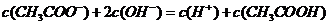
D.0.1mol·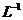 的
的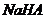 溶液,其pH=4:
溶液,其pH=4: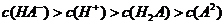
16.物质的鉴别有多种方法。下列能达到鉴别目的的是
①不用其它试剂,检验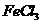 溶液和
溶液和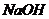 溶液
溶液
②用相互滴加的方法鉴别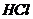 和
和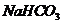 溶液
溶液
③点燃鉴别戊烷和苯
A①② B.①⑧ C.②③ D.①③③
15.500℃、20MPa时,将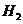 和
和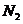 置于-容积为2L的密闭容器中发生反应。反应过程中
置于-容积为2L的密闭容器中发生反应。反应过程中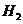 、
、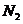 和
和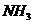 物质的量变化如右图所示,下列说法正确的是
物质的量变化如右图所示,下列说法正确的是
A.反应开始到第一次平衡时, 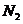 的平均反应速率为0.005mol/(L·min)
的平均反应速率为0.005mol/(L·min)
B.从曲线变化可以看出,反应进行到10min至20min时可能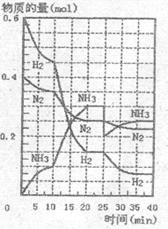 是使用了催化剂
是使用了催化剂
C.从曲线变化可以看出,反应进行至25min时,分离出0.1mo/L的氨气
D.在25min时平衡正向移动,但达到新平衡后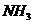 的体积分数比原平衡小
的体积分数比原平衡小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com