
3.据最新研究成果表明,在化疗(主要利用抗癌剂杀死癌细胞)的同时让实验鼠服用糖尿病的治疗药物二甲双胍,可抑制实验鼠体内的乳腺癌细胞扩散。下列相关叙述正确的是
( )
A.化疗能使实验鼠的血糖浓度升高导致乳腺癌细胞扩散
B.二甲双胍不可能导致实验鼠体内细胞表面的糖蛋白减少
C.原癌基因突变促使细胞癌变,抑癌基因突变抑制细胞癌变
D.一只切除胸腺的鼠与一只正常鼠患乳腺癌的几率相同
2.2009年全球爆发了甲型H1N1流感,世界卫生组织把对它的警戒级别提升为六级。下列相关叙述正确的是 ( )
A.接种甲型H1N1流感疫苗所引起的免疫属于非特异性免疫中的体液免疫
B.接种该疫苗后若再次接触该病的病原体,则机体可能会迅速反应产生大量抗体
C.该病的病原体因基因重组而容易变异,所以需要不断研制新疫苗
D.该病的病原体既能寄生在人的呼吸道中,也能在营养丰富的培养液中培养
1.下列关于生物科学发展史和科学方法的叙述,错误的是 ( )
A.孟德尔运用假说--演绎法揭示出遗传学的分离定律和自由组合定律
B.恩格尔曼的实验证明了氧气由叶绿体释放,叶绿体是光合作用的场所
C.温特的实验进一步证明了造成胚芽鞘弯曲的刺激确实是一种化学物质
D.坎农提出:神经-体液-免疫调节网络是机体维持稳态的主要调节机制
31.已知:Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,能氧化浓HCl
生成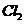 ;
;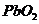 不稳定,随温度升高按下列顺序逐步分解:
不稳定,随温度升高按下列顺序逐步分解:
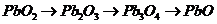 。
。
现将a mol 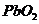 加热分解,收集产生的
加热分解,收集产生的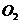 ;向加热后所得固体中加入足量的浓盐酸,
;向加热后所得固体中加入足量的浓盐酸,
收集产生的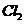 加热反应后所得固体中,Pb
加热反应后所得固体中,Pb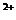 占Pb元素的物质的量分数为x;两步反应
占Pb元素的物质的量分数为x;两步反应
中收集的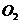 和
和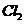 的物质的量之和为y mol。
的物质的量之和为y mol。
试回答下列问题:
(1)试写出Pb2O3与浓盐酸反应的化学方程式 。
(2)通过计算确定y与a、x的函数关系式。
(3)若两步反应中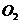 和
和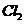 的物质的量之比为5:3,则剩余固体中含有的物质为
的物质的量之比为5:3,则剩余固体中含有的物质为
;其物质的量之比为 。


30.将一定量的NaOH与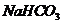 的混合物X,放在密闭容器中加热,充分反应以后放出
的混合物X,放在密闭容器中加热,充分反应以后放出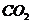 气体
气体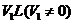 ,将反应后的固体残渣Y与过量盐酸反应,又生成
,将反应后的固体残渣Y与过量盐酸反应,又生成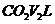 (均为标准状况下),则:
(均为标准状况下),则:
(1)Y的成分是 。
(2)X中NaOH与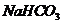 共
mol。
共
mol。
(3)原混合物中NaOH与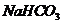 的物质的量之比为多少?
的物质的量之比为多少?
29.布噁布洛芬是一种消炎镇痛的药物。它的工业合成路线如下:
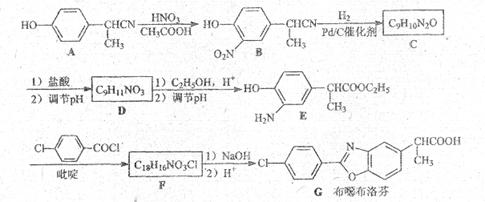
请回答下列阔题:
(1)A长期暴露在空气中会变质,其原因是 。
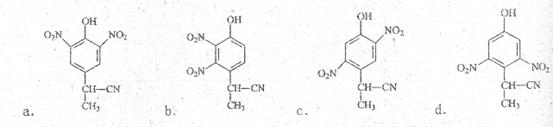
(2)由A到B的反应通常在低温时进行。温度升高时,多硝基取代副产物会增多。下列二硝基取代物中,最可能生成的是 。(填字母)
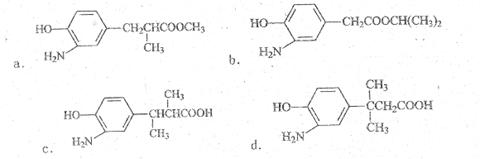
(3)一个碳原子连有四个不同的原子或基团,这个碳原子叫不对称碳原子,也叫手性碳原子。在E的下列同分异构体中,含有手性碳原子的分子是 。(填字母)
(4)F的结构简式 。
(5)D的同分异构体H是一种 氨基酸,H还可以与乙酸发生酯化反应,则H的结构简式是
。高聚物L由H通过肽键连接而成,L的结构简式是
。
氨基酸,H还可以与乙酸发生酯化反应,则H的结构简式是
。高聚物L由H通过肽键连接而成,L的结构简式是
。
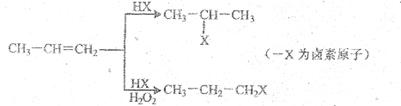
28.有机化学反应因反应条件不同,可生成不同的有机产品。侧如:
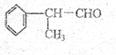
工业上利用上述信息,按下列路线合成结构简式为
的物质,它是一种香料。
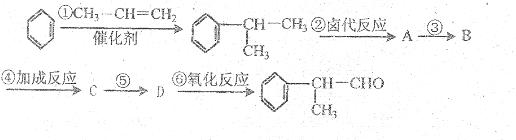
请根据上述路线,回答下列问题:
(1)A的结构简式可能为
(2)反应①、③、⑤的反应类型分别为 、 、 。
(3)反应④的化学方程式为(有机物写结构简式,并注明反应条件):
(4)这种香料具有多种同分异构体,其中某种物质有下列性质:①该物质的水溶液遇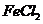 溶液显色②分子中有苯环,且苯环上的一溴代物有2种。写出符合上述两条件的物质可能的一种结构简式:
。
溶液显色②分子中有苯环,且苯环上的一溴代物有2种。写出符合上述两条件的物质可能的一种结构简式:
。
27.富碘卤中碘元素是以化合状态在的。在已经提取氯化钠、溴、镁等化学物质的富碘卤水中,采用下面的工艺流程生产单质碘:

(1)写出下列反应的离子方程式:
①沉淀反应
②置换反应II
(2)不溶物A是 和 的混合物,其中 物质可以循环使用。
(3)操作X是从置换反应II所得到的溶液中提取固体碘。
①操作中要加入的试剂是 (填试剂的名称)
②若所加试剂要循环使用,则操作X的步骤为
(4)为了测定富碘卤水中碘离子的含量,可用高锰酸钾滴定法。已知高锰酸钾和碘离子
的反应为: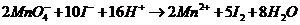 。填空:
。填空:
①取20.00mL,富碘卤水放入 (填仪器名称)中,将0.1mol/L的酸性高
 锰酸钾溶液装入滴定管中,达到滴定终点的标志是
。
锰酸钾溶液装入滴定管中,达到滴定终点的标志是
。
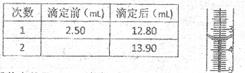
②两次滴定消耗高锰酸钾溶液的数据如下表:
请将第2次滴定前滴定管的读数
见右图)填入表中。并计算富碘卤中碘离子的浓度为 mol/L。精确到0.01)
③下列实验操作会引起实验结果偏高的是 (填编号)
A.装富碘卤水的容器用水洗净后,再用富碘卤水润洗
B.装高锰酸钾的滴定管用水洗净后,再用高锰酸钾溶液润洗
C.滴定前滴定管的尖嘴部分留有气泡,滴定后消失
D.滴定前仰视读数,滴定后俯视读数
(5)置换反应I之所以能发生是因为存在 平衡,该平衡的方程式为 。
26.某学习小组用右图装置测定铝镁合金中铝的质量分数和铝地相对原子质量。
(1)中试剂为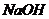 溶液,写出B中反应的离子方程式
。
溶液,写出B中反应的离子方程式
。
(2)实验前,先将铝镁合金在稀硝酸中浸泡片刻,再用蒸馏水洗净,其目的是 。
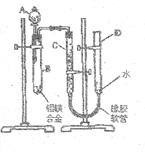 (3)如右图,连接好装置后,需进行的操作还有①记录C
(3)如右图,连接好装置后,需进行的操作还有①记录C
的液面位置;②将B中剩余固体过滤、洗涤、干燥,承重;
③待B中不再有气体产生并恢复至温室后,记录C的液面位
置;④由A向B中滴加足量试剂;⑤检查气密性;⑥将药品
和水装入各仪器中。上述操作的顺序是
(填序号);记录C的液面位置时,除视线平视外,还应 。
(4)若实验用铝镁合金的质量为
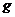 ,测得氢气体积为
,测得氢气体积为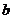

(已换算为标准状况),B中剩余固体质量为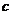
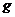 ,则铝的相对原子质量为
。
,则铝的相对原子质量为
。
(5)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将
(填“偏大”“偏小”、“不受影响”)
25.
在一密闭容器中发生反应: ,已知正反应速率
,已知正反应速率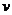 (正)和反应物A、B的浓度的关系是:
(正)和反应物A、B的浓度的关系是: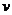 (正)=
(正)=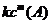 ·
·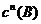 (
(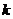 为常数)。实验测得有关数据如下:
为常数)。实验测得有关数据如下:

回答下列问题:
(1)A浓度对反应速率的影响 B浓度对反应速率的影响。(填 、
、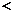 或=)
或=)
 (2)写出该反应的平衡常数表达式
。已知升高温度时,
(2)写出该反应的平衡常数表达式
。已知升高温度时,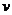 (正)
(正)
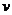 (逆),则该反应是 热反应,此时K值 (填“变大”“变小”或“不变”)
(逆),则该反应是 热反应,此时K值 (填“变大”“变小”或“不变”)
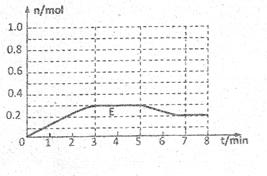
(3)将1mol A 和1 mol B 混合后装入
2L容器中发生反应,E的物质的量的变化
如图所示。
①3分钟内E的平均反应速率为
②请在图中画出5分钟内A的物质的量变化的曲线。
(4)已知在如图所示的变化中,平衡常数K保持不变,则在5-7min 内引起E的物质的量变化的原因可能是 (填编号)
①降低了温度 ②升高了温度 ③使用了催化剂 ④增大了容器的体积
⑤缩小了容器的体积 ⑥减少了A的物质的量
(5)在一定条件下,向2升密闭容器里冲入0.6mol A、0.8mol B 和0.4mol E 进行反应,某时刻测定物质的浓度不可能的事
A.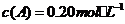 B.
B.
C.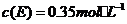 D.
D.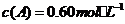
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com