
6.D 7.C 8.A 9.B 10.C 11.D 12.D
24.(20分)
①只有磁场时,电子运动轨迹如图1所示 (1分)
洛伦兹力提供向心力 Bev0=m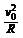 (1分)
(1分)
由几何关系 R2=(3L)2+(4L-R)2 (2分)
求出 B=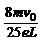 垂直纸面向里 (2分)
垂直纸面向里 (2分)
电子做匀速直线运动 Ee=Bev0 (1分)
求出 E=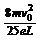 沿y轴负方向 (2分)
沿y轴负方向 (2分)
②只有电场时,电子从MN上的D点离开电场,如图2所示 (1分)
设D点横坐标为x x=v0t (2分)
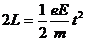 (2分)
(2分)
求出D点的横坐标为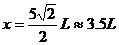 (1分)
(1分)
纵坐标为y=6L (1分)

③从A点到D点,由动能定理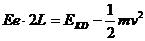 (2分)
(2分)
求出 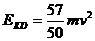 (2分)
(2分)
东城区普通校联考答案
高三 理科综合(化学部分) 2010年3月
23.(18分)
①雪橇先做加速运动,加速度逐渐减小,速度逐渐增大,然后做匀速运动。 (4分)
②雪橇速度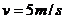 时,加速度a等于直线AD的斜率
时,加速度a等于直线AD的斜率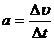 =2.5m/s2 ① (2分
)
=2.5m/s2 ① (2分
)
③空气阻力为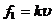 ,雪橇与斜坡间的摩擦力为
,雪橇与斜坡间的摩擦力为 ②
②
取人和雪橇为研究对象,由牛顿运动定律,得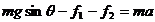
即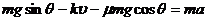 ③
(6分)
③
(6分)
由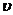 -t图象知
-t图象知 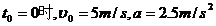 ,
,
代入③式得 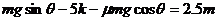 ④
(2分)
④
(2分)
当速度最大值时,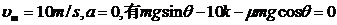 ⑤(2分)
⑤(2分)
联立④⑤两式,代入数据,得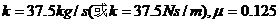 ⑥(2分)
⑥(2分)
22.(16分)
①由 E=NBSω (3分)
求出 E=16v (1分)
②由Im=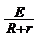 (3分)
(3分)
求出Im=1.6A (1分)
由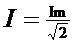 (3分)
(3分)
求出I=1.1A (1分)
③由P=I2R (3分)
求出约P=11W (1分)
(求出10.89-11.52都给分)
21. (18分)
(18分)
(1)①0.16 (0.15也算对)(3分)
②(见图)(3分)
③未计入砝码盘的重力。(2分)
(2) ① CADBFE;(2分) 600;(2分)
偏小(2分)
② B (2分) C(2分)
13.A 14.C 15.A 16.C 17.D 18.C 19.D 20.B
31.(18分)下图是我国南方开始尝试的农业生态系统的结构模式图,其中利用植物秸秆中的原料生产的燃料乙醇,是一种“绿色能源”,可减少对石油资源的依赖。请据图回答:
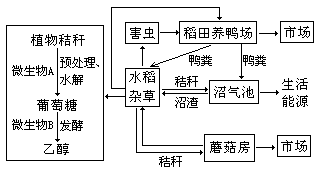
(1)该生态系统的主要成分是 。鸭与害虫、杂草的关系是 。蘑菇在该生态系统中的成分属于 。
(2)生态系统的主要功能是物质循环和能量流动,从生态学角度分析,人们建立图示的农业生态系统的主要目的是 。
(3)植物秸秆经预处理后,应该利用微生物A所产生的 酶进行水解,使之转化成发酵所需的葡萄糖。若从土壤中分离获取微生物A,应采用具有 功能的培养基,培养基中的碳源为 。
(4)发酵阶段常用的微生物B是 ,产生乙醇时的细胞呼吸类型是 。
东城区普通校联考答案
高三 理科综合(物理部分) 2010年3月
30.(14分) 疫苗对预防传染病具有重要意义。为研制抗某种病毒的灭活病毒疫苗,研究人员设计实验方案如下:
(1)制备疫苗
将纯化的某种病毒在特定的___________中培养、增殖。收获病毒后用灭活剂杀死,但要确保灭活病毒的抗原性物质不被破坏且能被免疫细胞识别。这样得到的灭活病毒即为本实验所用的疫苗。
(2)用实验动物检测疫苗刺激机体产生抗体的能力
① 实验原理:通过接种疫苗,灭活病毒进入实验动物体内可刺激 B 细胞,使之增殖、分化形成 并产生相应的抗体;当同种病毒再次入侵时,机体能产生更强的特异性免疫反应,包括____________。
② 实验过程:将健康的实验动物分成对照组和多个实验组,每组若干只动物。
对照组的处理:接种不含疫苗的接种物,一段时间后再___________。
实验组的处理:接种___________。一段时间后再接种病毒。
为确定该疫苗的有效浓度,不同实验组动物需接种____________的疫苗。
③分析实验结果:统计实验组和对照组动物的发病率、存活率。
若该疫苗可以刺激机体产生足够的抗体,则实验组与对照组相比,_____________。
29.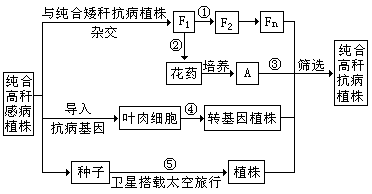 (18分)番茄的抗病(R)对感病(r)为显性,高秆(D)对矮秆(d)为显性,控制上述两对相对性状的基因分别位于两对同源染色体上。为获得纯合高秆抗病番茄植株,研究人员采用了下图所示的方法。
(18分)番茄的抗病(R)对感病(r)为显性,高秆(D)对矮秆(d)为显性,控制上述两对相对性状的基因分别位于两对同源染色体上。为获得纯合高秆抗病番茄植株,研究人员采用了下图所示的方法。
(1)在①处育种工作者应采用的方法是 。
(2)图中A代表的个体叫做 。③过程常用 处理萌发的种子或幼苗,过程②③的育种方法所依据的遗传学原理是 。
(3)过程④由导入抗病基因的叶肉细胞培养成转基因植株需要利用 技术,依据的原理是 。对获得的抗病基因常采用 技术进行体外的大量扩增。构建抗病基因表达载体时,必须使用 两种工具酶。
(4)过程⑤“航天育种”方法中主要的变异类型是 。
27.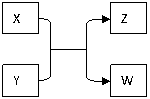 (16分)X、Y、Z、W四种物质有如下相互转化关系(其中
(16分)X、Y、Z、W四种物质有如下相互转化关系(其中
X、W为单质,Y、Z为化合物,未列出反应条件)。
Ⅰ.若Z是生活中常用的调味品,W遇淀粉溶液变蓝,则:
(1) 常温下,X的颜色是____________________。
(2) 工业上Z有多种用途,用化学方程式表示Z在工业生产上的一种重要用途______________________。
(3) 生活中所用的Z加入了碘酸钾,过量X与Y溶液反应时可以得到一种碘酸盐,此反应的离子方程式是____________________________。
Ⅱ.若X是工业上用量最大的金属单质,Z是一种具有磁性的黑色晶体,则:
(1) X与Y反应的化学方程式是________________________。
(2)
 若用下列装置只进行Z + W
X + Y反应(夹持装置未画出):
若用下列装置只进行Z + W
X + Y反应(夹持装置未画出):
|
|
|
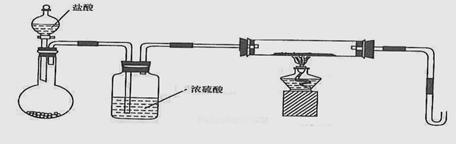

① 完成此实验有多步操作,其中三步是:
a.点燃酒精灯 b.滴加盐酸 c.检验气体纯度
这三步操作的先后顺序是___________________(填字母)。
② 为保证实验成功,上述装置需要改进,方法是(用文字叙述)____________________。
(3)将3.48 g Z加入50 mL 4mol/L的稀硝酸中充分反应,产生112 mL 的NO(标准状况),向反应后的溶液中滴加NaOH溶液能产生沉淀。当沉淀量最多,至少需要加入2mol/L的NaOH溶液___________ mL(精确到0.1)。
|
 2 NO
+ 2CO
2CO2 + N2 △H<0
2 NO
+ 2CO
2CO2 + N2 △H<0
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
|
时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
|
c(NO)/ mol·L-1 |
1.00×10-3 |
4.50×10-4 |
2.50×10-4 |
1.50×10-4 |
1.00×10-4 |
1.00×10-4 |
|
c(CO)/ mol·L-1 |
3.60×10-3 |
3.05×10-3 |
2.85×10-3 |
2.75×10-3 |
2.70×10-3 |
2.70×10-3 |
请回答(以下各题均不考虑温度变化对催化效率的影响):
(1)前2s内的平均反应速率v(N2)=___________________。
(2)在该温度下,反应的平衡常数K=__________________。
(3)在一定条件下,能够说明该反应达到平衡状态的标志是______________。
A.反应混合物各组分物质的量浓度相等
B.NO、CO、CO2、N2分子数之比为2:2:2:1
C.混合气体的平均相对分子质量不变
D.单位时间内消耗1 mol NO的同时,就有1 mol CO生成
(4)达到平衡后下列能提高NO转化率的是_________________。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(5)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸汽,并放出大量的热。已知0.4 mol 液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652kJ的热量。该反应的热化学方程式是_________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com