
16.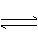
 (10分)大气固氮属于自然固氮,合成氨是目前人工固氮的主要方法。科学家一直致力“人工固氮”新方法的研究。
(10分)大气固氮属于自然固氮,合成氨是目前人工固氮的主要方法。科学家一直致力“人工固氮”新方法的研究。
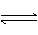
(1)有关大气固氮(以N2+02
2N0为例)、人工固氮(以N2+3H2 2NH3为例)反应的平衡常数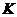 的值如下表。
的值如下表。
|
反应 |
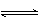 N2+02
2NO N2+02
2NO
|
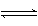 N2+3H2 2NH3 N2+3H2 2NH3 |
||
|
温度/℃ |
27 |
2000 |
100 |
400 |
|
K |
3.84×10-31 |
0.1 |
3.4×109 |
2.0x104 |
下列说法正确的是 。(填字母)
a.大气固氮与人工固氮都是放热反应
b.人类模拟大气固氮无现实意义
c.寻找在常温下合成氨的高效催化剂是目前人工固氮的新方向
 d.在常温下,人工固氮非常容易进行
d.在常温下,人工固氮非常容易进行
(2)已知:N2(g)+3H2(g) 2NH3(g) 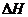 =-92.4kJ·mol-1
=-92.4kJ·mol-1
2H2(g)+02(g)=2H20(1)
 =-571.6
kJ·mol-1
=-571.6
kJ·mol-1
据报道,在常温、常压、光照、催化剂的条件下,N2可以与水反应,则反应
N2(g)+3H20(1)=2NH3(g)+3/2O2(g)的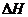 =
KJ·mol-1。
=
KJ·mol-1。
 (3)某研究小组在673 K、30 MPa下,在体积为
(3)某研究小组在673 K、30 MPa下,在体积为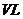 的密闭容
的密闭容
器中进行反应:N2(g)+3H2(g)
2NH3(g),其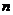
(H2)和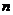 (NH3)随时间变化的关系如图所示。
(NH3)随时间变化的关系如图所示。
①下列叙述正确的是 。(填字母)
A.点a的正反应速率比点b的大
B.点c处反应达到化学平衡状态
C.若t3时由673 K升至773 K,则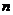 (H2)将增大
(H2)将增大
②从开始到平衡时反应的平均速率(以H2的浓度变化表示)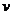 (H2)= 。
(H2)= 。
③若开始时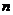 (N2)=
(N2)=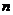 (H2),则反应的平衡常数
(H2),则反应的平衡常数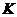 =
(用代数式表示)。
=
(用代数式表示)。
15.(10分)重铬酸钠(Na2Cr207)广泛用作氧化剂、鞣革剂等。以铬矿石(主要成分为Cr203,还含 有Fe0、Al203、Si02等杂质)为原料制取重铬酸钠的流程如下:
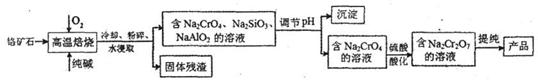
请回答下列问题:
(1)Cr2O3在高温焙烧时反应的化学方程式为 。
(2)生产过程中,调节(含Na2Cr04、Na2Si03、NaAlO2的溶液)pH的目的是 。
(3)某化工厂采用石墨作电极电解Na2Cr04溶液,实现了Na2Cr04转化为Na2Cr207的生产,其原理如右图所示。
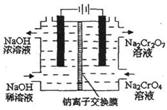
①写出阳极的电极方程式: ;
②此生产方法和上述流程相比的优点主要有 。
(4)Na2Cr207可用于测定废水的化学耗氧量(即COD,指每升水样中还原性物质被氧化所需要的02的质量)。现有某水样100.00 mL,酸化后加入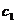 mo1/L的Na2Cr207溶液
mo1/L的Na2Cr207溶液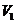 mL,使水中的还原性物质完全被氧化(还原产物为Cr3+);再用
mL,使水中的还原性物质完全被氧化(还原产物为Cr3+);再用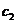 mol/L的FeS04溶液滴定剩余的Cr2072-,结果消耗FeS04溶液
mol/L的FeS04溶液滴定剩余的Cr2072-,结果消耗FeS04溶液 mL。则该水样的COD为
mg/L
mL。则该水样的COD为
mg/L
14.(8分)某兴趣小组根据金属镁与C02的反应,推测金属钠也能与C02发生反应,因此他们用下图所示的装置进行“钠与C02反应”的探究(尾气处理装置略去)。又知实验过程中的C02气体为足量;设能发生的反应都进行完全;一氧化碳气体可用氯化钯(PdCl2)溶液来检验(通过溶液颜色的变化来判断)。
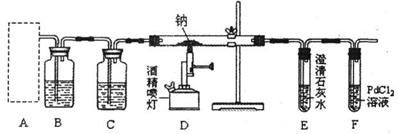
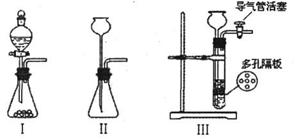
(1)为了使制取气体的装置能“随开随用,随关随停”,则在图中A处应选用的装置是 (填 “Ⅰ”、 “Ⅱ”或“Ⅲ”)。若要用干燥、纯净的C02气体与金属钠反应,则装置B中应盛放的试剂是 溶液。
(2)实验开始,检查装置的气密性完好并装入有关药品后,在点燃酒精喷灯前,还必
进行的实验操作是 。
(3)反应完成后,装置D玻璃管中残留的固体物质可能是 。(填字母)
a.Na202 b.Na2C03 C.NaHC03 d.Na2C03和C
(4)若D玻璃管中残留的固体是纯净物,则钠与C02反应的化学方程式是 。
(5)请设计合理的实验来检验某固体物质是Na2C03。答: 。
13.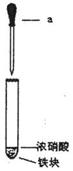 (6分)某化学学习小组用如图所示装置研究不同条件下铁与硝酸反应的情况。其实验步骤如下:
(6分)某化学学习小组用如图所示装置研究不同条件下铁与硝酸反应的情况。其实验步骤如下:
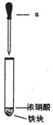 ①在大试管中先加入一小块铁(过量),再加入一定量的浓硝酸;
①在大试管中先加入一小块铁(过量),再加入一定量的浓硝酸;
②用仪器a再加入适量的水;
③反应结束后取少量上层溶液于另一试管中,滴加几滴KSCN溶液;
④再用仪器a向③的试管中滴加适量的稀盐酸。
请回答下列问题:
(1)仪器a的名称是 。
(2)步骤①无明显现象,原因是 。
(3)步骤④的主要现象是 ,有关反应的离 子方程式是 。
(4)学习小组在进行实验后发现该实验装置存在着一种明显的缺陷,请给出一种简单
的消除此缺陷的措施: 。
12.已知C0和H2在一定条件下合成甲醇的反应为:
 CO(g)+2M2(g) CH30H(g)
CO(g)+2M2(g) CH30H(g)
现在容积均为1 L的a、b、c三个密闭容器中分别充入1 mol C0和2 mol H2的混合气
体,控制温度,进行反应,测得相关数据的关系如图1和图2所示。
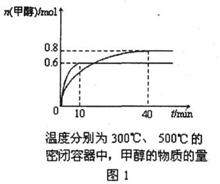
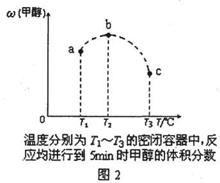
下列说法正确的是 ( )
A.该反应的正反应的△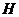 <0
<0
B.反应进行到5min时,a容器中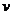 (正)=
(正)=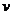 (逆)
(逆)
C.升温或减压,可将b中的平衡状态转变成c中的平衡状态
D.达到平衡时,a、b、c中C0的转化率为b>a>c
非选择题
11.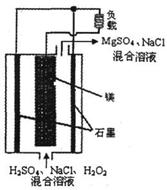 镁-过氧化氢燃料电池具有比能量高、安全方便等优点,
镁-过氧化氢燃料电池具有比能量高、安全方便等优点,
其结构示意图如图所示。 关于该电池的叙述正确的是
( )
A.该电池可以在高温下正常工作
B.电池工作时,H+向正极移动
C.电池工作时,正极周围溶液的pH将不断变小
D.该电池的总反应式为:
Mg+H202+H2S04=MgS04+2H20
10.下列溶液中微粒的物质的量浓度关系正确的是 ( )
A.向硝酸钙溶液里滴加稀盐酸得到pH=4的溶液中: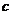 (Ca2+)=c(N03-)
(Ca2+)=c(N03-)
B.将0.2 mol·L-1
NaA溶液和0.1 mol·L-1盐酸等体积混合所得的碱性溶液中(A-为酸根离子):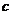 (Na+)>
(Na+)>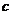 (A-)>
(A-)>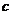 (Cl-)>
(Cl-)>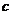 (OH-)
(OH-)
C.0.1 mol/L NaAl02溶液中: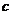 (Na+)>
(Na+)>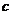 (A102-)>
(A102-)>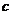 (OH-)>
(OH-)>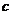 (H+)
(H+)
D.浓度均为0.1 mo1·L-1的CH3COOH、CH3COONa的混合溶液中:
2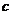 (OH-):2
(OH-):2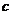 (H+)‘+
(H+)‘+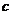 (CH3COOH)
(CH3COOH)
9.绿原酸是咖啡提取液的成分之一,其结构如图所示。下列关于绿原酸的说法正确的是
( )
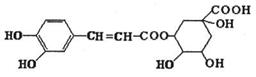
A.分子式为C16H1809
B.分子中有4个手性碳原子
C.水解产物都可以与FeCl3溶液发生显色反应
D.在一定条件下,1mol该物质最多与8molNaOH反应
8.下列离子方程式与所述事实相符且正确的是 ( )
A.用铁棒作阴极、炭棒作阳极电解饱和氯化钠溶液:
2C1-+2H20 H2↑+Cl2↑+20H-
H2↑+Cl2↑+20H-
B.用稀硝酸清洗做过银镜反应的试管:Ag+N03-+4H+=Ag++NO↑2H2O
C.向FeBr2溶液中通入过量的Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4C1-
D.在强碱性溶液中,次氯酸钠将Mn2+氧化成MnO2:
Mn2++C1O-+H2O=MnO2↓+C1-+2H+
7.下列化学实验事实及解释都正确的是 ( )
A.向Na2S03溶液中加入硝酸酸化的BaCl2溶液,有白色沉淀出现,说明Na2S03溶液已经变质
B.向皂化反应后的混合物中加入食盐可分离出高级脂肪酸钠,说明高级脂肪酸钠在此时容易析出
C.等体积、pH都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性:
HA>HB
D.向浓度均为0.1 mol/L的MgCl2、CuCl2混合溶液中逐滴加入少量氨水,先生成Cu(OH)2沉淀,说明Ksp[Cu(OH)2] >Ksp[Mg(OH)2]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com