
1.已知复数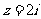 ,则
,则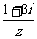 的虚部为 .
的虚部为 .
20.(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选择其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.零排放、太阳能、绿色光源等高科技点亮2010上海世博。
(1)世博园区外围设置生态化停车场,有害尾气被纳米光触媒涂料分解为无毒物质,汽车尾气中的下列物质属于由极性键形成的非极性分子的是 。
a.CO b.NO c.NO2 d.CO2
(2)“一轴四馆”中安装了高亮度节能的陶瓷金卤灯,金卤灯中填充物通常包含Na、81Tl、49In、Sc、I等元素的单质或化合物。有关说法正确的是 。
a.第ⅢA元素铊和铟,第一电离能Tl小于In
b.元素Sc位于周期表s区
c.钠的熔点低,是因为金属键较弱
d.12溶于KI溶液,可产生I3一,由价层互斥理论可推知I3一呈直线形
(3)世博锗广泛采用了冰蓄冷空调。冰蓄冷空调采用液态化合物乙二酵(HOCH2CH2OH)介质,乙二醇沸点高,是由于 。
(4)上海城区大规模集中使用“2l世纪绿色光源”LED半导体照明,LED晶片采厢砷化镓(GaAs)等材料组成。其中Ga原子在基态时,核外电子排布式为: 。GaAs的晶胞结构如右图,晶胞中含砷原子数为 。
(5)“东方之冠”(中国馆)表面装有7000多块红色铝板,红色铝板为新型氟碳喷涂型材,一种氟碳涂层聚脂(FEP),它的单体为CF3-CF=CF2,该分子中碳原子的杂化方式有: 。
B.铁强化酱油是在酱油添加食品强化剂--乙二胺四乙酸铁钠盐,乙二胺四乙酸铁钠盐化学式为:C10Hl2FeN2NaO8·3H2O,式量:421,EDTA铁钠盐呈浅土黄色结晶粉末,性稳定,易溶于水及难溶于乙醇。l%的水溶液pH约为3.5,可由乙二胺四乙酸一钠盐(NaH3EDTA)与氯化铁制取,制取原理如下:
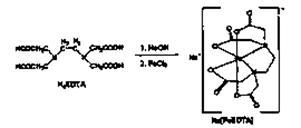
实验室制备NaFeEDTA·3H2O步骤如下:
①把0.4g(0.0lmo|)NaOH溶于l0mL蒸馏水,然后再加入3.8g(0.01mo1)Na2H2EDTA·2H2O,把溶液微热,直至固体完全溶解。
②用含有氯化铜杂质的氯化铁提纯并制得FeCl3·6H2O。称取2.5g(0.009mol)FeCl3·6H2O溶予5mL,蒸馏水中(并加l滴盐酸)。
③将①、②制得的两溶液混合
④加热溶液至沸腾,蒸发浓缩直至大部分粉末状的固体析出。
⑤冷却、采用右图装置减压过滤,先用冰水洗涤樗用乙醇洗涤。
⑥将固体凉干,称得制得的淡黄色粉末2.8g
试回答下列问题
(1)在步骤①中,须加入过量的碱,是因为 。
(2)将含有氯化铜杂质的氯化铁溶液分离可用的简单方法是 ;加显色利后分别发生反应的离子方程式为 ; 。
(3)步骤⑤中用冰水和乙醇洗涤的目的是, , 。
(4)本实验得到的是粉末状淡黄色的粉末,没有得到块状的晶体,可能的原因是: 。
(5)检验某品牌酱油中是否加有NaFeEDTA·3H2O,先取20mL酱油加入10rnL75%乙醇,将所得沉淀物溶于水,并用某盐酸调到pH<0.5,破坏配合物,然后加入某种铵盐检验,该铵盐是 (写化学式)。
(6)本次实验的NaFeEDTA·3H2O的实际产率为: 。
19.(10分)过氧化氢是重要的工业产品和实验室常用试剂。
(1)制取H2O2的方法很多,下列制取方法具有绿色环保,原子利用率最高的是 。
a.BaO2+H2SO4=BaSO4↓+H2O2
b.K2S2O8+2H2O=2KHSO4+H2O2
c.Na2O2+H2SO4+10H2O=Na2SO4·10H2O+H2O2
d.
(2)H2O2水溶液具有弱酸性,其电离方程式为: 。
(3)取氢气还原氧化铜后所得红色固体产物7.80g(含有Cu和并可能含有少量Cu2O、CuO),将其均分为两等份。一份在空气中灼烧到恒重为4.86g;另一份用含17%H2O2的酸性溶液至少 g,方可完全溶解,得蓝色溶液。
(4)为测定某钙片中H2O2残留,取25片(1.0g/片),研细、溶解、配成溶液250.00mL。取25.00mL,用0.01000mol·L-1酸性高锰酸钾溶液滴定(除H2O2外,其它物质不参与反应),耗去20.00mL。则钙片中H2O2残留为 mg/片。
17.(10分)铜和稀硝酸在常温常压下反应,开始时反应非常慢,但是随着反应的进行,反应速率不断地加大。某校合作学习小组的同学拟探究影响其速率的主要因素。
(1)甲同学认为是生成的Cu2+对该反应起催起作用,欲验证其假设是否正确,其实验方法是 。
(2)乙同学依据铜和硝酸是放热反应,拟研究温度升高是否为该反应速度率不断加大的主要原因,实验结果如下:
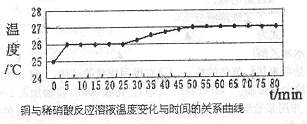
由此可得出的结论是: 。
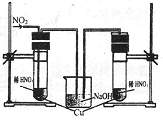 (3)丙同学查阅文献,得知稀硝酸与铜反应,还原产物起始也是NO2,NO2对该反应起催化作用。通过下列装置验证。实验发现左侧3min后开始大量产生气泡,右侧40min内无明显变化。
(3)丙同学查阅文献,得知稀硝酸与铜反应,还原产物起始也是NO2,NO2对该反应起催化作用。通过下列装置验证。实验发现左侧3min后开始大量产生气泡,右侧40min内无明显变化。
①氢氧化钠溶液的作用是 。
②该学生设计在左侧加的是2mol·L-1HNO3溶液,
右侧加的是2.2mol·L-1硝酸。左侧浓度稍偏小,
这样设计主要是考虑到 。
(4)丁同学与丙同学交流后,他将实验改进为:在试管中加入3mL2mol·L-1HNO3并放入铜片,然后加入几粒NaNO2晶体,发现只需1秒钟,铜片表面就开始产生气泡。由丁的实验可得出的结论是 。
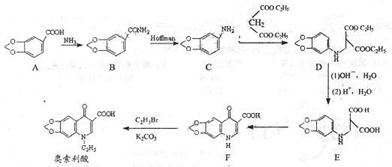 18.(12分)奥索利酸(Oxolinic Acid)属于黄樟素衍生物,是一种低毒高效杀菌剂,广泛用于养殖业。其合成路线如下:
18.(12分)奥索利酸(Oxolinic Acid)属于黄樟素衍生物,是一种低毒高效杀菌剂,广泛用于养殖业。其合成路线如下:
(1)B→C是NaClO和NaOH溶液作用下发生的霍夫曼降解反应,生成C的同时,生成的另一种含碳物质是 。C→D属于 反应(填反应类型)。
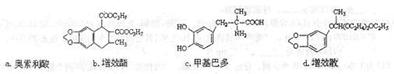 (2)下列物质均属于黄樟素的衍生物,其中含有手性碳原子的有
。
(2)下列物质均属于黄樟素的衍生物,其中含有手性碳原子的有
。
(3)满足下列条件,A同分异构体数目 种。
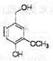 ①苯环上共有四个取代基
②除苯环外不含其它环状结构
①苯环上共有四个取代基
②除苯环外不含其它环状结构
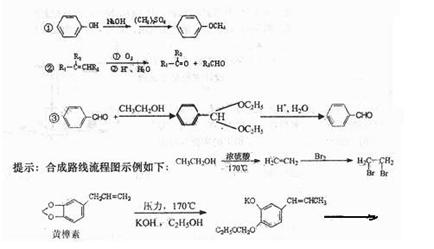
(4)试补充由黄樟素合成香兰醇 (用合成路线流程图表示,并注明反应条件)。
已知:
16.(8分)肼(N2H4)广泛用于火箭推进剂、有机合成及电池燃料。度回答下列问题
(1)联氨的工业生产常用氨和次氯酸钠为原料获得,也可在高锰酸钾催化下,尿素和次氯酸钠-氢氧化钠溶液反应获得,尿素法反应的化学方程式为: 。
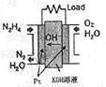
(2)直接肼燃料电池原理如右图所示,通入N2H4的极为电池的 极。
 (3)火箭常用N2O4作氧化剂,肼作燃料,已知:
(3)火箭常用N2O4作氧化剂,肼作燃料,已知:
N2(g)+2O2(g)=2NO2(g) △H=-67.7kJ·mol-1,
N2H4(g)+O2(g)=N2(g)+2H2O(g)
△H=-534.0kJ·mol-1
 2NO2(g) N2O4(g) △H=-52.7kJ·mol-1
2NO2(g) N2O4(g) △H=-52.7kJ·mol-1
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式: 。
(4)肼的水合物(水合肼,N2H4·2H2O)是一种强还原剂,某文献报道用Fe-Al复合催化剂催化水合肼可选择性还原对氯硝基苯制备对氯苯胺,某次实验部分记录如下:
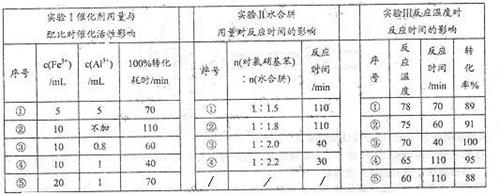
请分别从实验Ⅰ、Ⅱ、Ⅲ组合出最佳条件依次为 (选用序号①②③④⑤)。
15.(8分)为了节能减排,提高综合经济效益,某工厂采用焦炉气--含硫烟道气联合生产硫酸铵和亚硫酸氢铵两种产品,其工艺流程图如下:
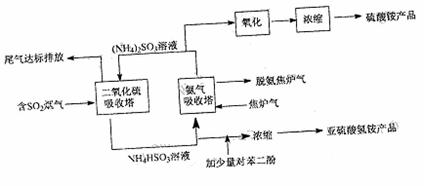
(1)下列有关说法正确的是 。
a.含SO2烟气直接排放易引起酸雨
b.焦炉气若用河水洗涤后直接排放,易引起水体的富营养化
c.脱氨焦炉气可作燃料发电
d.检验硫酸铵产品中是否混有较多的亚硫酸铵杂质,可用溴水作试剂
(2)生产亚硫酸氢铵时,加入少量对苯二酚的作用是 。
(3)氨气吸收塔中发生反应的离子方程式为: 。
(4)已知烟气含SO2%,焦炉气中含NH34.8%,若只生产硫酸铵一种产品,吸收后的尾气中所含的SO2或NH3可忽略。则含SO2烟气与焦炉气的流量(每分钟流过的体积)比为 。
13.(10分)MgSO4·7H2O医药上用作泻剂。工业上用氯碱工业中的一次盐泥为原料生产。已知一次盐泥中含有美、钙、铁、铝、锰的硅酸盐和碳酸盐等成分。主要工艺如下:
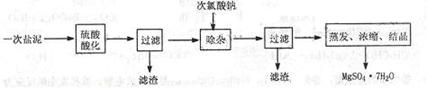
(1)用硫酸调整溶液pH到1~2,硫酸的作用是 。
(2)加次氯酸钠溶液至pH=5~6并加热煮沸约5~10分钟,滤渣中主要含MnO2和另两种沉淀,另两种沉淀是 (写化学式)。其中次氯酸钠溶液将MnSO4转化为MnO2的离子方程式为: 。
(3)若除杂后过滤,发现滤液发黄,需采取的措施是 。
(4)过滤后晶体常用丙酮代替蒸馏水洗涤的目的是 。
(5)晶体中结晶水含量的测定:准确称取0.20g MgSO4·7H2O样品,放入已干燥至恒重的瓷坩埚,置于马弗炉中,在200℃脱水1小时。为准确确定脱水后的质量,还需要经过的操作有:冷却(干燥器中)至室温→ 。
(6)硫酸根离子质量分数的测定:准确称取自制的样品0.50g,用200mL水溶液,加入2mol·L-1HCl溶液5mL,将溶液加热至沸,在不断搅拌下逐滴加入5~6mL0.5mol·L-1BaCl2溶液,充分沉淀后,得沉淀0.466g,则样品中w(SO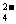 )=
。
)=
。
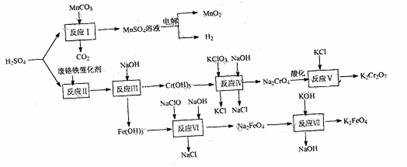 14.(8分)以提银后含锰废液中获得的碳酸锰、废硫酸及废铬铁催化剂等为原料生产二氧化锰、高铁酸钾及重铬酸钾,原料的综合利用率较高。其主要流程如下:
14.(8分)以提银后含锰废液中获得的碳酸锰、废硫酸及废铬铁催化剂等为原料生产二氧化锰、高铁酸钾及重铬酸钾,原料的综合利用率较高。其主要流程如下:
(1)电解硫酸锰酸性溶液时,阳极的电极反应为: 。
(2)反应IV中,每生成1molNa2CrO4消耗KClO3 mol。
(3)已知反应V是复分解反应。用离子反应方程式表示Na2CrO4溶液酸化时化学平衡的移动: 。
(4)反应VI的离子方程式为: 。
12.在t℃时,Ag2CrO4(橘红色)在水中的沉淀溶解平衡平衡曲线如图所示。又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是 ( )
A.在t℃时,Ag2CrO4的Ksp为1×10-8
B.在饱和溶液中加入K2CrO4可使溶液由Y点到X点
 C.在t℃时,Ag2CrO4(s)+2Cl-(aq)
2AgCl(s)+CrO
C.在t℃时,Ag2CrO4(s)+2Cl-(aq)
2AgCl(s)+CrO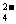 (aq)
(aq)
 平衡常数K=6.25×107
平衡常数K=6.25×107
D.在t℃时,以0.001mol/L AgNO3溶液滴定
20mL0.001mol/L KCl和0.001mol/L的K2CrO4
的混合溶液,Cl-先沉淀
第Ⅱ卷(非选择题,共78分)
11.下列溶液中微粒的物质的量浓度关系正确的是 ( )
A.Ca(ClO)2溶液中:c(Ca2+)>c(ClO-)>c(OH-)>c(H+)
B.等体积、等物质的量浓度的NaX和弱酸HX混合:c(Na+)=c(X-)>c(OH-)=c(H+)
C.常温下,将25mL0.2mol/L的盐酸与100mL0.1mol/L的氨水混合,所得溶液中:
c(NH4+)> c(Cl-)>c(NH3·H2O)>c(OH-)>c(H+)
D.将0.1mol/L的Na2S溶液与0.1mol/L的NaHS溶液等体积混合,所得溶液中:
c(S2-)+2c(OH-)=2c(H+)+c(HS-)+3c(H2S)
10.臭氧是常见的强氧化剂,广泛用于水处理系统。制取臭氧的方法很多。其中高压放电法和电解纯水法原理如下图所示,下列有关说明不正确的是 ( )
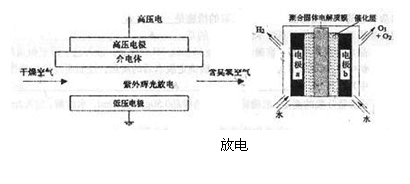
A.高压放电法,反应的原理为:3O2 2O3
B.高压放电出来的空气中,除含臭氧外还含有氮的氧化物
C.电解法,电极b周围发生的电极反应有:3H2O-6e-=O3+6H+;2H2O-4e-=O2+4H+
D.电解时,H+由电极a经聚合固体电解质膜流向电极b
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com