
19.
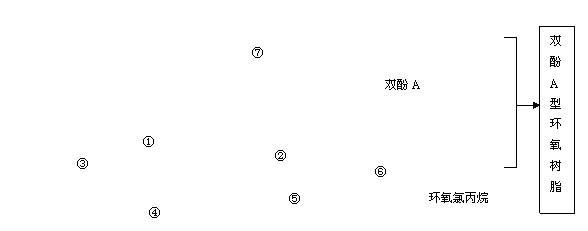 (13 分)双酚A型环氧树脂是由双酚A、环氧氯丙烷在碱性条件下缩合而成的高分子化合物。具有良好的物理化学性能,被广泛应用于涂料、胶粘剂等领域。根据该树脂的合成路线图示,回答以下问题:
(13 分)双酚A型环氧树脂是由双酚A、环氧氯丙烷在碱性条件下缩合而成的高分子化合物。具有良好的物理化学性能,被广泛应用于涂料、胶粘剂等领域。根据该树脂的合成路线图示,回答以下问题:
(1)写出上图中②⑥两步的反应方程式:
②____________________________ ⑥_____________________________
(2)H2C=CHCH2OOCCH3有多种同分异构体, 其中能发生银镜反应,且核磁共振氢谱上只有两种峰,强度比为3:1的同分异构体的结构简式为___________; 其中既可以和NaHCO3溶液又能与溴水反应的物质有 种(不考虑立体异构)。
(3)双酚A的另一重要用途是和光气(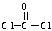 )合成Lexan聚碳酸酯(一种高强材料,可用于制作防弹窗户)。写出此合成反应的化学方程式:_________________________ 。
)合成Lexan聚碳酸酯(一种高强材料,可用于制作防弹窗户)。写出此合成反应的化学方程式:_________________________ 。
(4)已知 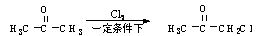

试以丙酮为原料,采用与上图所示不同的合成路线合成环氧氯丙烷。请用合成反应流程图表示出合成方案(注明反应条件)。
提示:①合成过程中无机试剂任选
②反应流程图表示方法示例:

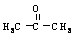


18.(10分)现已确认,SO2和NOx的排放是造成酸沉降的两大罪魁祸首。下图表示了某地区在1940~2002年间,空气中SO2和NOx含量因燃料燃烧、工业生产、交通运输以及其他因素的影响而发生变化的基本统计数据。

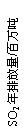


(1)结合上图数据,判断下列说法正确的是( )
A.在交通运输中排放的NOx与燃料的不充分燃烧有关
B.在上世纪60年代以前,在交通运输中排放的SO2主要是使用燃煤的内燃机所致
C.近年来在工业生产中SO2排放量的下降,主要是减少了燃烧的煤的质量
D.随着汽车工业的发展,在形成酸雨的因素中,NOx所占比重在逐渐增大
(2)在上图表示的历史进程中,在工业生产所导致的SO2的排放量明显地在逐年减少。请用化学方程式说明人类在为解决SO2污染问题中所进行的一个反应过程:
_______________________________________________。
(3)汽车排放的尾气中含有未燃烧充分的CH、以及N2、CO2、NO、CO等。有人设计利用反应2NO
+ 2CO  N2 + 2CO2 将有害的污染物转化为可参与大气循环的N2和CO2。
N2 + 2CO2 将有害的污染物转化为可参与大气循环的N2和CO2。
在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
|
时间/h |
0 |
1 |
2 |
3 |
4 |
5 |
|
c(NO)/mol·L-1 |
1.00×10-3 |
4.5×10-4 |
2.5×10-4 |
1.5×10-4 |
1.00×10-4 |
1.00×10-4 |
|
c(CO)/mol·L-1 |
3.6×10-3 |
3.05×10-3 |
2.85×10-3 |
2.75×10-3 |
2.70×10-3 |
2.70×10-3 |



 在上述条件下反应能够自发进行,则反应的
在上述条件下反应能够自发进行,则反应的 0(“>”、“<”、“=”)。
0(“>”、“<”、“=”)。 前2h内的平均反应速率v(N2)= _____________
前2h内的平均反应速率v(N2)= _____________ ,在该温度下,反应的平衡常数K=
。据此你认为将该反应从理论转化为现实的最重要的研究方向是________________________________。
,在该温度下,反应的平衡常数K=
。据此你认为将该反应从理论转化为现实的最重要的研究方向是________________________________。
(4)某次降雨过程收集到10L的雨水,向雨水中滴加1mL6mol/L的H2O2,充分反应后测得溶液的pH=3.62 [c(H+) =2.4×10-4 mol/L ]),再向溶液中加入足量的Ba(OH)2溶液,经过滤、晾干、称重,得沉淀的质量为0.1864g。若假设与水的酸性仅由NOx和SO2的排放所致。请写出将H2O2加入到与水中与含硫化合物反应的离子方程式_____________________________________,并计算排放在空气中的NOx和SO2的物质的量之比接近于__________。
17.(12分)对碳及其氧化物的化学热力学、动力学研究有助于人类充分利用化石燃料,消除碳氧化物对环境的负面影响。
请回答下列问题:
(1) 25℃时,石墨和CO的燃烧热分别为:393.5kJ/mol、283.0kJ/mol。请写出石墨不完全燃烧时的热化学方程式 ;
(2)25℃时,反应2CO2 (g) 2CO(g)+O2(g)的平衡常数K=2.96×10-92。在一个体积可变的密闭容器(起始时的容器体积为1L)中充入一定量的CO2、CO、O2混合气体,要使容器中的反应开始时向CO2分解的方向移动,则起始时充入的三种气体的物质的量应满足的关系是
。当该反应在25℃时达到平衡后,其它条件不变时,升高温度或增加容器的压强,均能使该平衡发生移动,请在下列坐标中作出该反应的平衡常数K随温度(T)、压强(P)变化而变化的示意图:
2CO(g)+O2(g)的平衡常数K=2.96×10-92。在一个体积可变的密闭容器(起始时的容器体积为1L)中充入一定量的CO2、CO、O2混合气体,要使容器中的反应开始时向CO2分解的方向移动,则起始时充入的三种气体的物质的量应满足的关系是
。当该反应在25℃时达到平衡后,其它条件不变时,升高温度或增加容器的压强,均能使该平衡发生移动,请在下列坐标中作出该反应的平衡常数K随温度(T)、压强(P)变化而变化的示意图:
(3) 1 600℃时,反应2CO(g)+O2(g)
 2CO2(g)的平衡常数K=1×108。经测定,汽车尾气中CO和CO2气体的浓度分别为4.0×10-5mol/L和4.0×10-4mol/L。若在汽车的排气管上增加一个1 600℃的补燃器并不断补充O2使其浓度始终保持为4.0×10-4mol/L。则CO的补燃转化率为
;
2CO2(g)的平衡常数K=1×108。经测定,汽车尾气中CO和CO2气体的浓度分别为4.0×10-5mol/L和4.0×10-4mol/L。若在汽车的排气管上增加一个1 600℃的补燃器并不断补充O2使其浓度始终保持为4.0×10-4mol/L。则CO的补燃转化率为
;
(4) 以CO和O2为电极燃料,以熔融K2CO3为电解质组成燃料电池,请写出该电池的负极反应方程式 。
16.(8分)下图中的反应①是重要的电化学工业反应,反应②可用于制备新型消毒净水剂Na2FeO4。常温下B、C为气态单质,G是当代社会使用量最大的金属,其余均为化合物。(反应时加入或生成的水,以及生成沉淀I时的其他产物均已略去) 。
 请回答下列问题:
请回答下列问题:
(1)L的电子式为_______________。
(2)J溶液蒸干灼烧得到的物质是(填化学式) _______________。
(3)反应①的化学方程式是____________________________________。
(4)反应②的离子方程式是____________________________________。
15.(10分)高锰酸钾是锰的重要化合物和常用的氧化剂。以下是实验室中模拟工业上用软锰矿制备高锰酸钾的流程图。
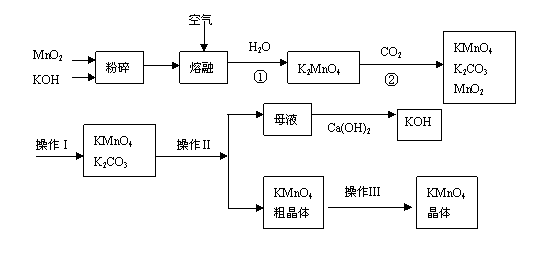

(1)操作Ⅰ的名称为__________;操作Ⅲ的名称为__________。
(2)反应②的化学方程式为 。
工业上用上述原理生产KMnO4方法产率较低,较好的制备方法是电解法。用Pt作阳极,Fe作阴极,K2MnO4为电解液,阳极的电极反应式为 。
(3)KMnO4是一种较稳定的化合物,但日光对KMnO4溶液的分解有催化作用,生成MnO2、KOH和O2。而 MnO2也是该分解反应的一种催化剂,请你设计一个实验方案,验证MnO2对该分解反应具有催化性。简述实验操作、现象及相关结论: 。
(4)KMnO4在酸性介质中的强氧化性广泛应用于分析化学中。
例如:2KMnO4+3H2SO4+5Na2SO3=5Na2SO4+K2SO4+2MnSO4+3H2O。某同学用KMnO4测定实验室长期存放的Na2SO3固体的纯度。现欲准确称取6.3 g Na2SO3固体样品,配成500 mL溶液。取25.00 mL上述溶液放入锥形瓶中,用0.01000 mol/L 的酸性KMnO4溶液进行滴定。滴定结果如下表所示:
|
滴定次数 |
待测溶液的体积/mL |
标准溶液的体积 |
|
|
滴定前刻度/mL |
滴定后刻度/mL |
||
|
1 |
25.00 mL |
0.02 |
24.01 |
|
2 |
25.00 mL |
0.70 |
24.71 |
|
3 |
25.00 mL |
0.20 |
24.20 |
① 配制500 mLNa2SO3溶液时,必须用到的实验仪器有:烧杯、玻璃棒、胶头滴管、药匙和__________________、_________________。
② 判断滴定终点的依据是_______________________________。
③ 用上述实验数据,计算Na2SO3的纯度为__________________。
14.常温下,下列溶液的pH或微粒的物质的量浓度关系不正确的是
A.某物质的溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,则该溶液的pH一定为14-a
B.某溶液中存在的离子有S2-、HS-、OH-、Na+、H+,则离子浓度一定是
c(Na+) >c(S2-) >c(OH-) >c(HS-) >c(H+)
C.pH=3的二元弱酸H2R溶液与 pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:2c(R2-)+ c(HR-)=c(Na+)
D.将0.2 mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:2c(OH-)=2c(H+)+c(HA)-c(A-)
13.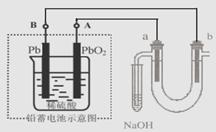 用铅蓄电池电解苦卤水 (含C1―、Br―、Na+、Mg2+)的装置如图所示 (a、b为石墨电极)。
用铅蓄电池电解苦卤水 (含C1―、Br―、Na+、Mg2+)的装置如图所示 (a、b为石墨电极)。
下列说法中正确的是
A.铅蓄电池放电时,该电池两极质量均增加
B.铅蓄电池充电时,A极应与外电源负极相连
C. 电解苦卤水时,a 电极首先放电的是Br―而不是Cl―, 说明当其它条件相同时Br―的还原性强于Cl―
D.当b极产生0.01mol 气体时,铅蓄电池中消耗0.01 mol H2SO4
12.下列反应的离子方程式正确的是
A.NaHSO4溶液中滴入Ba(OH)2溶液至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
B.向NH4HCO3溶液中加入足量NaOH溶液:NH4++OH-= NH3↑+H2O
C.向NaAlO2 溶液中通入过量CO2: 2AlO2-+CO2+3H2O =2Al(OH)3↓+ CO32-
D.将SO2气体通入NaClO溶液中:SO2 + 2ClO-+ H2O = SO32- + 2HClO
11. 已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是
|
选项 |
W |
X |
|
A |
盐酸 |
Na2CO3溶液 |
|
B |
Cl2 |
Fe |
|
C |
CO2 |
Ca(OH)2溶液 |
|
D |
NH3·H2O |
AlCl3溶液 |
10.西维因是一种高效低毒杀虫剂,在碱性条件下可水解:

有关说法正确的是
A.西维因分子式为C12H10NO2
B.反应后经酸化,可用FeCl3溶液检验是否发生水解
C.1mol西维因最多能与6mol氢气发生加成反应
D.西维因分子中至少有21个原子共平面
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com