
2、史学家唐德刚在《晚清七十年》中写道“从秦国开始的我国史上第一次社会政治大转型,发自商鞅,极盛于始皇,而完成于汉武”。这次“转型”的主要表现是
A、世袭制代替禅让制 B、郡县制代替分封制
C、行省制代替郡国制 D、内阁制代替三省制
1、儒家经典把君子人格的修养 完成设计为“修身、齐家、治国、平天下”的历练。从“个人”到“家”、再到“天下”的这种逐层扩展的关系,实质上体现了
A、世袭制 B、宗法制 C、分封制 D、郡县制
24.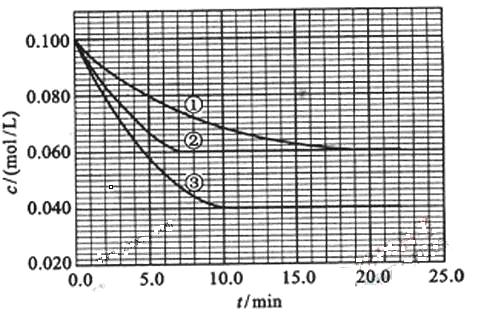 (10分) 在溶液中,反应A+2B
(10分) 在溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200mol/L及c(C)=0mol/L。反应物A的浓度随时间的变化如下图所示。
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200mol/L及c(C)=0mol/L。反应物A的浓度随时间的变化如下图所示。
请回答下列问题:
(1)写出该反应的平衡常数表达式:K=___________________;
(2)与①比较,②和③分别仅改变一种反应条件。所改变的条件分别是:
② ; ③ ;
(3)实验②平衡时B的转化率为 ;实验③平衡时C的浓度为 。
 温州市2009学年第二学期高二年级期末四校联考
温州市2009学年第二学期高二年级期末四校联考
23.(14分)纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。制备纳米TiO2的方法之一是TiCl4水解生成TiO2·x H2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2 。用现代分析仪器测定TiO2粒子的大小。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+ ,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
请回答下列问题:
(1)检验TiO2·x H2O中Cl-是否被除净的方法是______________________________。
(2)下列可用于测定TiO2粒子大小的方法是_____________________(填字母代号)。
a.核磁共振法 b.红外光谱法 c.质谱法 d.透射电子显微镜法
(3)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是_________________;使用的仪器除天平、药匙、玻璃棒、烧杯、量简外,还需要下图中的_____(填字母代号)。
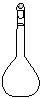

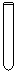

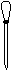

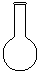

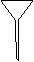

a b c d e
(4)滴定终点的现象是___________________________________________________。
(5)滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol·L-1 NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为_________________________。
(6)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
① 若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果_______。
② 若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果_________。
22.(16分)某兴趣小组为验证日常生活用的火柴头上只含有KClO3、MnO2、S,
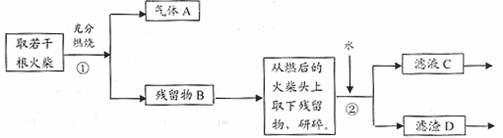 设计了以下实验流程图,请回答以下问题:
设计了以下实验流程图,请回答以下问题:
 (1) 写出步骤①中可能发生一个反应的化学方程式 。
(1) 写出步骤①中可能发生一个反应的化学方程式 。
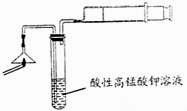
(2)为验证气体A,按右图所示进行实验:若能
观察到 的现象,即可证明火柴头上含有S元素。
(3) 步骤②的实验操作装置如右下图所示
a.该操作的名称是 。
 b.写出图中A仪器的名称: __ ___;
b.写出图中A仪器的名称: __ ___;
c.该装置图有几处错误.
请指出B仪器处关键性的错误:__ ______
C仪器处的错误改进后应是: 。
(4)要证明火柴头中含有Cl元素,
在步骤②以后的实验步骤是 。
(5)有学生提出检验火柴头上中含有Cl元素,另一套实验方案:
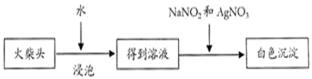
请写出有关的离子反应方程式为 ,
有人提出上述方法中出现白色沉淀并不能充分说明火柴头上KClO3的存在,其理由是 。
21.(10分)请你按下列要求书写相应的方程式:
(1)用离子方程式解释NaAlO2溶液的碱性:
(2)5.6g金属铁与盐酸完全反应生成氯化亚铁溶液与氢气,同时放出热量Q KJ。
写出此反应热化学方程式: 。
(3)一种新型的熔融盐燃料电池具有高发电效率而备受重视。现用Li2CO3和Na2CO3的熔融盐混合物做电解质,一极通入CO气体,另一极通入空气与CO2的混合气体,制得燃料电池。已知此燃料电池的负极反应式:CO+CO32--2e-=2CO2
则该电池工作时的正极反应式为: .
(4) FeCl3溶液腐蚀印刷电路铜板的,请写出该离子方程式为: 。
(5)将(4)反应设计成原电池,请在方框内画出原电池的装置图(标出正、负极、溶液)。
20.把物质的量均为0.1mol的AlCl3、CuCl2和H2SO4溶于水制成100ml的混合溶液,用石墨做电极电解,并收集两电极所产生的气体,一段时间后在两极收集到的气体在相同条件下体积相同。则下列描述正确的是
A.电路中共转移0.9mol电子
B.阳极得到的气体中有O2且其物质的量为0.35mol
C.阴极质量增加3.2g
D.铝元素以Al(OH)3的形式存在
19. X、Y、Z三种气体,取X和Y按1:1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y 2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则Y的转化率最接近于
2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则Y的转化率最接近于
A.33% B.40% C.50% D.65%
18.下列叙述正确的是
A. 某醋酸溶液的PH= a,将此溶液稀释1倍后,溶液的PH= b,则a>b
B. 在滴有酚酞溶液的氨水中,加入NH4Cl的溶液恰好无色,则此时溶液的PH< 7
C. 1.0×10-3mol/L盐酸的PH=3.0,1.0×10-8mol/L盐酸PH=8.0
D. 若1mL PH=1盐酸与100mL MaOH溶液混合后,溶液PH=7,则NaOH溶液的PH=11
17.草酸是二元弱酸,草酸氢钾溶液呈酸性。在0.1 mol·L-1 KHC2O4溶液中,
下列关系不正确的是:
A.c(K+)+c(H+) = c(HC2O4-) + c(OH-) + 2 c(C2O42-)
B.c(HC2O4-) + c(C2O42-) = 0.1 mol·L-1
C.c(C2O42-) > c(H2C2O4)
D.c(K+) = c(H2C2O4) + c(HC2O4-) + c(C2O42-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com