
8. 若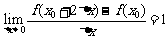 ,则
,则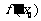 等于( )
等于( )
A.2
B.-2
C. 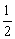 D.
D.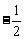
7.已知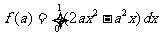 ,则
,则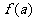 的最大值是( )
的最大值是( )
A. 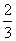 B.
B. 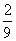 C.
C. 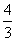 D.
D. 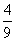
6.曲线y=x3-1在x=1处的切线方程为( )
A.y=2x-2 B.y=3x-3 C. y=1 D. x=1
5.由直线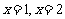 ,曲线
,曲线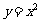 及
及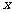 轴所围图形的面积为 ( )
轴所围图形的面积为 ( )
A.3
B.7
C.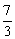 D.
D. 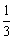
4.若复数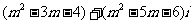 是虚数,则实数
是虚数,则实数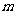 满足( )
满足( )
A.  B.
B. 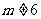 C.
C.  或
或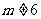 D.
D.  且
且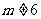
3. 抛物线y2= 4x上一点P到焦点F的距离是10, 则P点的坐标是 ( )
(A)(9, 6) (B)(6, 9) (C)(±6, 9) (D)(9,±6)
2.物体运动方程为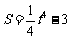 ,则
,则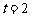 时瞬时速度为( )
时瞬时速度为( )
A.2 B.4 C. 6 D.8
有一项是符合题目要求的,请把正确答案涂在答题卡上.)
1. 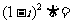 ( )
( )
A.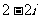 B.
B. C.
C. D.
D.
3、化学实验设计时,应全方位思考的问题
(1)检查气体的纯度,点燃或加热通有可燃性气体(H2、CO、CH4、C2H4、C2H2等)的装置前,必须检查气体的纯度。例如用H2、CO等气体还原金属氧化物时,需要加热金属氧化物,在操作中,不能先加热,后通气,应当先通入气体,将装置内的空气排干净后,检查气体是否纯净(验纯),待气体纯净后,再点燃酒精灯加热金属氧化物。
(2)加热操作先后顺序的选择。若气体发生需加热,应先用酒精灯加热发生气体的装置,等产生气体后,再给实验需要加热的固体物质加热。目的是:一则防止爆炸(如氢气还原氧化铜);二则保证产品纯度,防止反应物或生成物与空气中其它物质反应。例如用浓硫酸和甲酸共热产生CO,再用CO还原Fe2O3,实验时应首先点燃CO发生装置的酒精灯,生成的CO赶走空气后,再点燃加热Fe2O3的酒精灯,而熄灭酒精灯的顺序则相反,原因是:在还原性气体中冷却Fe可防止灼热的Fe再被空气中的O2氧化,并防止石灰水倒吸。
(3)冷凝回流的问题。有的易挥发的液体反应物,为了避免反应物损耗和充分利用原料,要在发生装置设计冷凝回流装置。如在发生装置安装长玻璃管等。
(4)冷却问题。有的实验为防止气体冷凝不充分而受损失,需用冷凝管或用冷水或冰水冷凝气体(物质蒸气),使物质蒸气冷凝为液态便于收集。
(5)防止倒吸问题。主要是氨气、氯化氢等易溶于水气体的制备。
(6)具有特殊作用的实验改进装置。如为防止分液漏斗中的液体不能顺利流出,用橡皮管连接成连通装置;为防止气体从长颈漏斗中逸出,可在发生装置中的漏斗末端套住一只小试管等。
(7)拆卸时的安全性和科学性。实验仪器的拆卸要注意安全和科学性,有些实验为防止“爆炸”或“氧化”,应考虑停止加热或停止通气的顺序,如对有尾气吸收装置的实验,必须将尾气导管提出液面后才熄灭酒精灯,以免造成溶液倒吸;用氢气还原氧化铜的实验应先熄灭加热氧化铜的酒精灯,同时继续通氢气,待加热区冷却后才停止通氢气,这是为了避免空气倒吸入加热区使铜氧化,或形成可爆气;拆卸用排水法收集需加热制取气体的装置时,需先把导管从水槽中取出,才能熄灭酒精灯,以防止水倒吸;拆后的仪器要清洗、干燥、归位。
考点一 化学基本操作
[例1] 下列实验能达到实验目的且符合安全要求的是( )
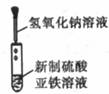
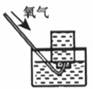
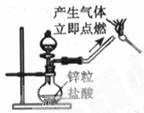
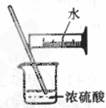
A.制备氢氧化亚铁 B.收集氧气 C.制备并检验氢气的可燃性 D.浓硫酸稀释
并观察其颜色
[解析]氢氧化亚铁易被O2氧化,胶头滴管必须插入溶液中,选项A错误。O2难溶于水,可以用排水法收集,选项B正确;点可燃性气体前必须验纯,选项C错误;浓硫酸的稀释应将浓硫酸加入水中,选项D错误。
[答案]B
考点二 化学仪器
[例2] 有关实验的叙述,正确的是( )
A、将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液
B、用玻璃棒蘸取溶液,点在湿润的pH试纸上测定其pH
C、用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应
D、读取滴定管内液体的体积,俯视读数导致读数偏小
[解析]不能直接在容量瓶中溶解并配制溶液;pH与氢离子的浓度有关,若将试纸润湿,则因导致浓度减小,有可能出现误差;NaOH中的Na有焰色反应,所以会影响实验结果。滴定管的刻度从上向下依次增大,所以俯视刻度,会使读数比实际值小。
[答案]D
考点3 化学药品的取用
[例3]下列做法正确的是 ( )
A.将浓硝酸保存在无色玻璃瓶中
B.用镊子取出白磷并置于水中切割
C.把氯酸钾制氧气后的残渣倒入垃圾桶
D.氢气还原氧化铜实验先加热再通氢气
[解析]浓硝酸见光易分解,不能保存在无色瓶中,故A错误;实验中的剩余药品等不能倒入垃圾桶,应放入指定的回收容器中,故C错误;D应先通入氢气排尽装置中的空气再加热。[来源:]
[答案]B
考点四 物质的鉴别
[例4]下列各组物质的无色溶液,不用其它试剂即可鉴别的是 ( )
①KOH、Na2SO4、AlCl3 ②NaHCO3、Ba(OH)2、H2SO4
③HCl、NaAlO2、NaHSO4 ④Ca(OH)2、Na2CO3、BaCl2
A.①② B.②③ C.①③④ D.①②④
[解析]①Na2SO4与其它物质反应都无沉淀;KOH与AlCl3互滴,现象不同:一是先沉淀后溶解;一是沉淀立即消失,之后沉淀不再消失。②Ba(OH)2和NaHCO3以及H2SO4反应都有沉淀生成,所以很容易找出Ba(OH)2,关键是NaHCO3与H2SO4的区别,二者互滴的现象差异不大,不易区分,区别的方法是:Ba(OH)2与一物生成沉淀后,用其沉淀与另一物质反应,若有气体放出,则原沉淀为BaCO3,若无气体放出,则原沉淀为BaSO4。③中NaHSO4相当于一元强酸,三种物质中,利用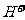 与
与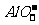 互滴现象不同,只能鉴别出NaAlO2。④中由于
互滴现象不同,只能鉴别出NaAlO2。④中由于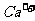 和
和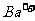 均能与
均能与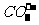 生成沉淀,三种物质中只能鉴别出
生成沉淀,三种物质中只能鉴别出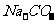 。
。
[答案]A
考点 性质实验方案的设计与评价
[例5]根据硫化氢气体的实验室制法和性质完成下列填空。
(1)若用启普发生器制取硫化氢气体,则制取气体的原料可选用________。
a.稀硫酸与硫化亚铁 b.稀硝酸与硫化亚铁
c.稀硫酸与硫化钠 d.稀盐酸与硫化亚铁
(2)现要组装一套可以控制硫化氢气体产生速率的装置,请在下图中选择合适的仪器;
______________(填编号)。
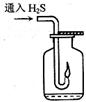
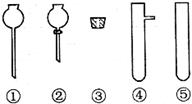
(3)如图,在一个充满氧气的集气瓶中加入少量品红溶液,点燃硫化氢气体。在火焰自动熄灭后,停止通入气体,瓶内可观察到的现象是________________________。
(4)在上述集气瓶中继续通入硫化氢气体,振荡,发生反应的化学方程式为:
______________________________________________________________
反应过程中,溶液的pH______(填“变大”、“变小”或“不变”)。
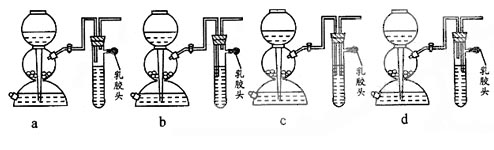
(5)点燃不纯的硫化氢气体可能会发生爆炸,为了防止意外,可连接一个安全装置。下图的装置能起到此作用的是___________。
(6)已知硫化氢气体在空气中的体积分数为4.3%-45.5%时会发生爆炸。当硫化氢气体在空气中的体积分数为30%时,其爆炸产物是______________________。
[解析](1)可选用强酸和硫化物,但硫化物必须难溶于水才能使用启普发生器,所以选ad。
(2)可以控制硫化氢气体产生速率的装置,所给的仪器中只有则不然需要②能起到控制的作用,所以②必选,有了②那么③和④就是它的配套仪器了。所以选②③④
(3)H2S点燃生成SO2,SO2能使品红褪色,由于火焰自动熄灭所以H2S燃烧不充分会有S单质的生成,所以现象就是品红溶液褪色:瓶壁有淡黄色粉末和无色的小液滴
(4)H2S继续通入则与SO2发生反应,2H2S+SO2 3S↓+2H2O,酸性减弱,PH变大。
3S↓+2H2O,酸性减弱,PH变大。
(5)四套装置中不同之处就在于右侧导管的进气和出气管的位置,a没有效果,c出气和进气都插在液体中达不到出气的效果,d中同样达不到出气的效果,所以选择b装置。
(6)硫化氢气体在空气中的体积分数为30%,则O2的量不足,所以发生不完全燃烧,产物为S和H2O。
[答案](1)a d
(2)② ③ ④
(3)品红溶液褪色:瓶壁有淡黄色粉末和无色的小液滴
(4)SO2+2H2S=3S↓+2H20 变大
(5)b
(6)S H2O
考点六 探究性试验设计与评价
[例6]三草酸合铁酸钾晶体K3 [Fe(C3O4 )3]·3H2O可有于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究。请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。限选试剂:浓硫酸、1.0 mol·L-1HNO、1.0 mol·L-1盐酸、1.0 mol·L-1 NaOH、3% H2O2 、0.1mol·L-1KI、0.1 mol·L-1CuSO4、20% KSCN、澄清石灰水,氧化铜、蒸馏水。
(1)将气体产物依次通过澄清石灰水(A)、浓硫酸、灼热氧化铜(B)、澄清石灰水(C)观察到A、C中澄清石灰水都变浑浊,B中有红色固体生成,则气体产物是 。
(2)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3。验证固体产物中钾元素存在的方法是 ,现象是 。
(3)固体产物中铁元素存在形式的探究。
①提出合理假设
假设1: ; 假设2: ;假设3: 。
②设计实验方案证明你的假设(不要在答题卡上作答)
③实验过程
根据②中方案进行实验。在答题卡上按下表的格式写出实验步骤、预期现象与结论。
|
实验步骤 |
预期现象与结论 |
|
步骤1: |
|
|
步骤2: |
|
|
步骤3: |
|
|
········· |
|
[解析](1)将产生的气体产物依次通过澄清石灰水,石灰水变混浊,说明产生的气体中含有CO2,然后再通过灼热氧化铜、澄清石灰水,观察到有红色固体生成,澄清石灰水都变浑浊,气体中含有CO;(2)碱金属元素的检验一般采用颜色反应;(3)依据信息:固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3,可推测铁元素只能以亚铁及铁单质的形式存在;在设计实验时,应注意Fe与FeO的性质的不同点。
[答案](1)CO和CO2
(2)焰色反应;透过蓝色钴玻璃观察到紫色火焰
(3)①全部为铁单质;全部为FeO;同时存在铁单质和FeO;
③
|
步骤1:取适量固体产物于试管中,加入足量蒸馏水,充分振荡是K2CO3完全溶解。分离不溶固体与溶液,用蒸馏水充分洗涤不溶固体。 |
固体产物部分溶解 |
|
步骤2:向试管中加入适量CuSO4溶液,再加入少量上述不溶固体,充分振荡。 |
①若蓝色溶液颜色及加入的不溶固体物明显变化,则假设2成立。 ②若蓝色溶液颜色明显改变,且有暗红色固体物质生成,则证明有铁单质存在。 |
|
步骤3:继续步骤2中的②,进行固液分离,用蒸馏水洗涤固体至洗涤液无色。去少量固体于试管中,滴加过量的HCl后,静置,取上层溶液,滴加适量的H2O2,充分振荡后滴加KSCN。 |
结合步骤2中的② ①若溶液基本无色,则假设1成立。 ②若溶液呈血红色,则假设3成立。 |
变式1 下列实验装置图正确的是 ( )
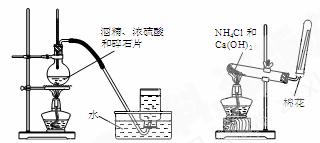

A.实验室制乙烯 B.实验室制氨 C.实验室制氯气 D.实验室制乙酸乙酯
解析:选项A中温度计的水银球应插入反应液面以下,A错。选项C中实验室用MnO2和浓盐酸制备Cl2时必须加热,C错。选项D中导管伸入饱和Na2CO3溶液中,易引起倒吸,D错。
答案:B
变式2 在允许加热的条件下,只用一种试剂就可以鉴别(NH4)2SO4、KCl、MgCl2、Al2(SO4)3和Fe2(SO4)3溶液,这种试剂是 ( )
A.NaOH B.NH3·H2O C.AgNO3 D.BaCl2[来源:高&考%资(源#网]
解析:NaOH与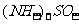 加热反应有刺激性气味气体产生;与KCl不反应,无明显现象;与MgCl2反应生成白色沉淀;与
加热反应有刺激性气味气体产生;与KCl不反应,无明显现象;与MgCl2反应生成白色沉淀;与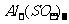 反应生成白色沉淀,当NaOH过量时,白色沉淀溶解;
反应生成白色沉淀,当NaOH过量时,白色沉淀溶解;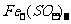 反应时,有红褐色沉淀产生。
反应时,有红褐色沉淀产生。
答案:A
变式3以下对化学实验的描述合理的是 ( )
A.配制一定物质的量浓度的硫酸溶液时,应将量取好的浓硫酸先入烧杯中,然后加水稀释
B.中和滴定实验前,所使用的滴定管和锥形瓶必须洗净,并用待测液润洗
C.用于检验气体的试纸一般需先润湿
D.硫酸铜晶体结晶水含量的测定实验中,盛晶体的坩埚灼烧后,需放在石棉网上冷却后称量
解析:浓硫酸稀释时要将浓硫酸慢慢加入水中,故A错;中和滴定时,锥形瓶盛放的是待测液,不能先润洗,故B错;在检验气体的试纸要先用水润湿,但用pH试纸测定溶液pH值时不能先用水润湿,故C正确;放在石棉网上冷却,会重新吸收空气中的水蒸气,故应放在干燥器中冷却。
答案:C
变式4下述实验不能达到预期目的的是
|
编号 |
实验内容 |
实验目的 |
|
A |
将SO2通入酸性KMnO4溶液中 |
证明SO2具有还原性 |
|
B |
将Cl2通入NaBr溶液中 |
比较氯与溴的氧化性强弱 |
|
C |
将铜与浓硝酸反应生成的气体收集后用冰水混合物冷却降温 |
研究温度对化学平衡的影响 |
|
D |
分别向2支试管中加入相同体积不同浓度的H2O2溶液,再向其中1支加入少量MnO2 |
研究催化剂对H2O2分解速率的影响 |
解析:SO2可以与KMnO4酸性溶液反应,使其褪色;浓度对反应速率也有影响,用不同浓度的H2O2溶液,再向其中1支加入少量MnO2,反应速率的不同不能说明是催化剂的影响,故应选择相同浓度的溶液进行实验。
答案:D
变式5实验室用下列装置所示的流程进行气体性质实验。图中用箭头表示气体的流向,A为一种纯净、干燥的气体,B是另一种气体,己中有红棕色气体出现。实验中所用的药品只能从下列物质中选取:Na2CO3、NaHCO3、Na2O、Na2O2、NaCl、无水CaCl2、(NH4)2CO3、碱石灰等固体和蒸馏水。
根据图中装置和现象回答:
(1)丙中发生反应的化学方程式为 。
(2)丁中应选用的干燥剂是___ __,为什么不选用所给的另一种干燥剂__ __。
(3)甲中发生反应的化学方程式______________ ____。
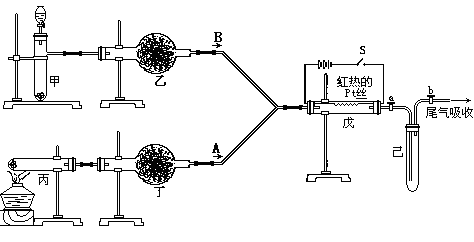
(4)戊中发生的主要反应的化学方程式 _。此反应是吸热反应还是放热反应__ __,估计可看到什么现象足以说明你的判断 。
解析:根据乙中有红棕色气体产生,是在红热铂丝催化下有A、B两种气体生成的,根据所学知识可知,在戊中发生的反应为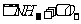

 ,A、B为
,A、B为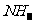 和
和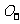 ,根据所给药品知道,丙中制备的是NH3,其反应为
,根据所给药品知道,丙中制备的是NH3,其反应为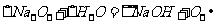 。丁中的干燥剂是碱石灰,用来干燥氨气,同时除去
。丁中的干燥剂是碱石灰,用来干燥氨气,同时除去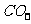 ,而无水氯化钙再不能吸收
,而无水氯化钙再不能吸收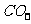 。
。
答案:(1)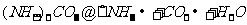
(2)碱石灰 因为另一种干燥剂的无水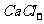 ,只能吸收水,不能吸收
,只能吸收水,不能吸收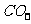 ,不能使氨气完全净化。
,不能使氨气完全净化。
(3)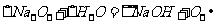
(4)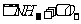

 放热 可以看到戊中铂丝比开始反应时更加红热
放热 可以看到戊中铂丝比开始反应时更加红热
2、化学实验设计思想、规律和方法
(1)思考问题的顺序:
① 围绕主要问题思考。例如:选择适当的实验路线、方法;所用药品、仪器简单易得;实验过程快速、安全;实验现象明显。
② 思考有关物质的制备、净化、吸收和存放等有关问题。例如:制取在空气中易水解的物质(如Al2S3、AlCl3、Mg3N2等)及易受潮的物质时,往往在装置末端再接一个干燥装置,以防止空气中水蒸气进入。
③ 思考实验的种类及如何合理地组装仪器,并将实验与课本实验比较、联靠。例如涉及到气体的制取和处理,对这类实验的操作程序及装置的连接顺序大体可概括为:发生→除杂质→干燥→主体实验→尾气处理。
(2)仪器连接的顺序:
① 所用仪器是否恰当,所给仪器是全用还是选用。
② 仪器是否齐全。例如制有毒气体及涉及有毒气体的实验应有尾气的吸收装置。
③ 安装顺序是否合理。例如:是否遵循“自下而上,从左到右”;气体净化装置中不应先经干燥,后又经过水溶液洗气。
④ 仪器间连接顺序是否正确。例如:洗气时“进气管长,出气管短”;干燥管除杂质时“大进小出”等。
(3)实验操作的顺序:
① 连接仪器。按气体发生→除杂质→干燥→主体实验→尾气处理顺序连接好实验仪器。
② 检查气密性。在整套仪器连接完毕后,应先检查装置的气密性,然后装入药品。检查气密性的方法要依装置而定。
③ 装药品进行实验操作。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com