
27、化学能转化为电能、a--b、 增大气体的接触面积、Li、H2O
26、第三周期、第三主族 NH3、N2H4 34 H2SeO4
29.(15分)t℃时,将 2molSO2 和 1molO2 通入体积为 2L 的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g)==2SO3(g) ,△H=-196.6kJ/mol. 2min 时反应达到化学平衡,此时测得反应物O2 还剩余 0.8mol,请填写下列空白:
(1)从反应开始到达化学平衡,生成 SO3 的平均反应速率为 ;平衡时,SO2 转化率为
(2)下列叙述能证明该反应已达到化学平衡状态的是
A.容器内压强不再发生变化 B.SO2 的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗 2nmolSO2 的同时消耗 nmolO2
E.相同时间内消耗 2nmolSO2 的同时生成 nmolO2
F.混合气体密度不再变化
(3)以下操作会引起化学反应速率变快的是
A.向容器中通入O2 B.扩大容器的体积 C.使用正催化剂
D.升高温度 E.向容器中通入氦气。
(4)t2℃时,若将物质的量之比 n(SO2) :n(O2)=1:1 的混合气体通入一个恒温恒压 的密闭容器中,反应达到平衡时,混合气体体积减少了 20%。则SO2 的转化率为 。
填空答案:
28.(15分)莽草酸是制取H1N1流感药物(达菲)的主要原料。其的结构式为:
请回答以下问题:
(1)莽草酸的分子式为
。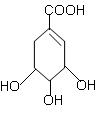
(2)莽草酸分子中含有的官能团的名称 。
(3)莽草酸不可能发生的化学反应类型是 。
A.与酸性高锰酸钾溶液发生氧化反应 B.与溴水发生取代反应
C.与醋酸发生酯化反应 D. 与氢氧化钠溶液发生中和反应
(4)1mol莽草酸与足量NaOH反应,消耗NaOH的物质的量为 mol。
(5)1mol莽草酸与足量金属钠反应,理论上最多消耗钠的质量为 g。
(6)写出莽草酸与溴水反应的化学反应方程式
27.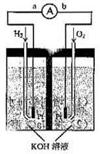 (14分)氢氧燃料电池是绿色化学发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,附气体的能力强,性质稳定,请回答:
(1)氢氧燃料电池的能量转化主要形式是
,在导线中电子流动方向为 (用a、b表示)。
(2)正极反应式为
。
(14分)氢氧燃料电池是绿色化学发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,附气体的能力强,性质稳定,请回答:
(1)氢氧燃料电池的能量转化主要形式是
,在导线中电子流动方向为 (用a、b表示)。
(2)正极反应式为
。
负极反应式为 。 (3)电极表面涂镀铂粉的原因为 (4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,安全储氢是关键技术之一金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2 2LIH
Ⅱ.LiH+H2O==LiOH+H2↑
反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
2LIH
Ⅱ.LiH+H2O==LiOH+H2↑
反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
26.(16分)X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。回答下列问题:
(1) L的元素符号为________ ;M在元素周期表中的位置为_______________;五种元素的原子半径从大到小的顺序是_________________(用元素符号表示)。
(2)Z、X两种元素按原子数目比l∶3和2∶4可构成分子A和B,A的电子式为___ ,B的结构式为____________。
(3)硒(se)是人体必需的微量元素,与L同主族,Se原子比L原子多两个电子层,则Se的原子序数为_____,其最高价氧化物对应的水化物化学式为__ __。
25.从海水中可获得的在常温下为液体的单质是( )
A.Mg B.K C.Br2 D.I2
第Ⅱ卷(非选择题,共60分)
24.工业上冶炼铝通常采用的方法是( )
A.电解法 B.铝热反应法
C.氢气或CO还原法 D.热分解法
23.下列叙述错误的是( )
A.乙烯和苯都能使溴水褪色,褪色的原因相同
B.淀粉、油脂、蛋白质都能水解,但水解产物不同
C.煤油可由石油分馏获得,可用作燃料和保存少量金属钠
D.乙醇、乙酸、乙酸乙酯都能发生取代反应。
22.下列烷烃中沸点最高的是( )
A.乙烷 B.正丁烷 C.正戊烷 D.新戊烷
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com