
30.(14分)下图中A、B、C、D、E都是链状有机化合物。A分子中只含氯原子一种官能团,B物质能发生银镜反应。
已知:

请回答下列问题:
(1)A的分子式为 。
(2)B分子中含有的官能团的名称是 。
(3)指出反应类型:B→ ;D→E 。
(4)写出D→E的化学方程式(有机物用结构简式表示) 。
(5)写出符合下列条件的B同分异构体的结构简式 。
①水解产物之一为甲醇;②与金属钠反应放出氢气。
29.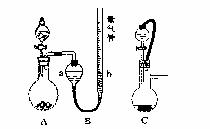 (17分)某课题研究小组,探究镁粉与铝粉组成的混合物中铝元素的含量,甲同学利用A、B装置进行实验探究,供选药品有:①混合物样品;②浓硫酸;③稀硫酸;④氢氧化钠溶液。
(17分)某课题研究小组,探究镁粉与铝粉组成的混合物中铝元素的含量,甲同学利用A、B装置进行实验探究,供选药品有:①混合物样品;②浓硫酸;③稀硫酸;④氢氧化钠溶液。
(1)甲同学实验前必须进行的实验操作是 ,
方法是 。
(2)该同学用托盘天平称取0.3g 混合物样品,置于A
中,从分液漏斗中滴加足量的稀硫酸,当无气泡放
出时测得气体体积(折合为标准状况)为336mL,
该同学测得样品中铝的质量百分含量是 。
(3)该同学在最后读数时应注意的问题是 (填写字母)。
A.将烧瓶中的气体赶到气管中 B.等冷却到室温后再读数
C.调整a装置与b装置液面相平 D.视线与液面最低点相平
(4)乙同学认为:即使各项操作均正确,甲同学所测得的样品中铝的质量百分含量一定会 (填“偏低”,“偏高”或“无法确定”)
(5)经思考,乙同学决定用C装置代替甲同学方案中的A装置进行实验,这样改进的优点是:① ;② 。
(6)丙同学认为用供选药品中的另一种代替稀硫酸进行实验,会使计算更方便,请你用离子方程式表示丙同学的实验原理 。
28.(15)原子序数依次增大的五种短周期元素X、Y、Z、O、R,已知X与Q同主族,Y、Z原子序数之比为3:4,Z的最外层电子数 是Q的最外层电子数的6倍,R为同周期中原子半径最小的元素(稀有气体元素除外),X与R形成的化合物常温下为气态,
是Q的最外层电子数的6倍,R为同周期中原子半径最小的元素(稀有气体元素除外),X与R形成的化合物常温下为气态,
(1)表示Y元素中质子数与中子数相等的同位素符号是 。
(2)Q与Z形成的原子个数比为1:1的化合物的电子式是 。
(3)A+B→C+D+H2O为中学化学中常见的反应形式,A、B、C、D均为由上述五种元素组成的单质或化合物。
①如A为NaOH、B为CO2时,可写成
aNaOH+bCO2=cNa2CO3+dNaHCO3+H2O,a与b的物质的量之比应满足的关系是 。现向100mL、3mol/L的NaOH溶液中缓慢通入标准状况下4.48L的CO2气体,用1个化学方程式表示以上反应 (化学计量数为最简整数)。此时溶液中各种离子物质的量浓度由高到低的排列顺序是 。
②请任写一个符合A+B→C+D+H2O形式的氧化还原反应方程式其中C、D均为盐 。
27. (14分)已知二元酸H2A在水中存在以下电离:H2A=H++HA+,HA+ H++A2+,试回答下列问题:
(14分)已知二元酸H2A在水中存在以下电离:H2A=H++HA+,HA+ H++A2+,试回答下列问题:
(1)NaHA溶液呈 (填“酸”、“碱”或“中”)性,理由是 。
(2)某温度下,向10mL、0.1mol/L NaHA溶液中加入0.1mol/L KOH溶液V mL至中性,此时溶液中以下关系一定正确的是 (填写字母)。
A.溶液pH=7 B.水的离子积KW=[c(OH-)]2
C.V=10 D.c(K+)<c(Na+)
 (3)已知速溶物CaA在水中存在溶解平衡:CaA(s) Ca2++A2-;△H>0,一定温度下CaA饱和溶液中c(Ca2+)c(A2-)为常数
(3)已知速溶物CaA在水中存在溶解平衡:CaA(s) Ca2++A2-;△H>0,一定温度下CaA饱和溶液中c(Ca2+)c(A2-)为常数 ,记作Kap=c(Ca2+)c(A2-),Kap只与温度有关。
,记作Kap=c(Ca2+)c(A2-),Kap只与温度有关。
①温度升高时,Kap (填“增大”、“减小”或“不变”,下同)。
②向浊液中通入HCl气体,c (Ca2+)
,原因是
。
(Ca2+)
,原因是
。
(4)测得25℃时,CaA的Kap为2.0×10-11,常温下将10gCaA固体投入100mL CaCl2溶液中,充分搅拦后仍有固体剩余,测得溶液中c(Ca2+)=0.1mol/L,测溶液中c(A2+)= 。
13.复方蒿甲醚是由中国首先发现的可用于治疗疟疾的药物,目前在国际上获得 广泛认可。其主要成分是青蒿素,青蒿素的结构简式如图所示。有关青蒿素的说法不正确的是
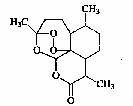 ( )
( )
A.青蒿素分子式为C15H32O5
B.在一定条件下1mol青蒿素能与含1molNaOH
的溶液完全反应
C.青蒿素分子中含有过氧链,一定条件下有氧化性
D.青蒿素易溶于水
第Ⅱ卷(非选择题,共13题,174分)
12.一定质量的铁和铜的混合物,与一定浓度的硝酸反应后容器中没有固体剩余。生成标准状况下2.24LNO和4.4 8LNO2(不考虑N2O4的存在)的混合气体,则参加反应的HNO3的物质的量是 ( )
8LNO2(不考虑N2O4的存在)的混合气体,则参加反应的HNO3的物质的量是 ( )
A.1.6mol B.1.0mol C.0.8mol D.0.5mol
11.图为一带可移动隔板的密 闭容器,某温度下,左、右两侧反应达平衡,此时隔板处于容器中央。若保持温度不变,向左侧容器中充入一定量的H2,下列说法正确的是( )
闭容器,某温度下,左、右两侧反应达平衡,此时隔板处于容器中央。若保持温度不变,向左侧容器中充入一定量的H2,下列说法正确的是( )

A.两侧平衡均向正反应方向移动 B.左侧平衡向逆反应方向移动
C.右侧平衡向逆反应方向移动 D.两侧平衡均向逆反应方向移动
10.观察图示装置,下列说法错误的是 ( )
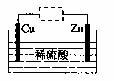 A.虚线框内接灵敏电流计,该装置可将化学能转化为电能
A.虚线框内接灵敏电流计,该装置可将化学能转化为电能
|
B.虚线框中接直流电源,可能发生反应:Cu+H2SO4 CuSO4+H2↑
|
C.虚线框内接直流电源,可能发生反应:Zn+H2SO4 ZnSO4+H2↑
D.生成2.24LH2时,一定转移0.2 mol电子
9.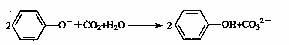 下列离子方程式书写正确的是 ( )
下列离子方程式书写正确的是 ( )
A.苯酚钠溶液中通入少量CO2:
B.MgSO4溶液中加入Ba(OH)2溶液:SO42-+Ba2+=BaSO4↓
|
D.实验室制备Fe(OH)3胶体:Fe3++3H2O Fe(OH)3(胶体)+3H+
8.下列操作的先后顺序正确的是 ( )
A.稀释浓硫酸时,先将浓硫酸倒入烧杯中,再缓慢加入适量蒸馏水
B.皮肤上不慎沾上少量浓硫酸,立即用大量水冲洗,再涂抹适宜浓度的小苏打溶液
C.中和滴定用的锥形瓶先用蒸馏水洗涤,再用标准溶液润洗
D.精制含有Ca2+、Mg2+ 、SO42-的粗盐时,先加Na2CO3,再加BaCl2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com