
38.[化学--选修有机化学基础](15分)
某化合物A在一定条件下能发生如下图所示的转变:
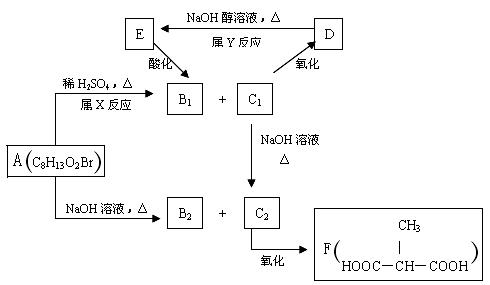
其中只有B1既能使溴水褪色,又能与Na2CO3 溶液反应放出CO2 ,回答下列问题:
(1)指出反应类型:X 反应,Y 反应。
(2)物质A的结构简式为 。
(3)写出C1 
 C2的化学方程式
。
C2的化学方程式
。
(4)与F互为同分异构体(分子中无环状结构)且核磁共振氢谱只有一种峰的有机物的结构简式有 。(写一种)
(5)与C2具有相同官能团的同分异构体(不包括C2,同个碳原子上不能有多个羟基)共有 种。
28.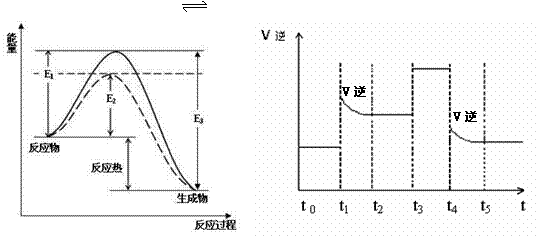 (14分)可逆反应N2+3H2 2NH3是工业上合成氨的重要反应。
(14分)可逆反应N2+3H2 2NH3是工业上合成氨的重要反应。
图1 (图中表示生成1mol物质时的能量) 图2
(1)根据图1请写出合成氨的热化学方程式 (热量用E1、E2或E3表示)
(2) 图1中虚线部分是通过改变化学反应中的 条件,请解释原因
。
(3)当反应达到平衡位置时不断改变条件(不改变N2、H2和NH3的量),图2表示反应速率与反应过程的关系,其中表示平衡混合物中NH3的含量最高的一段时间是
(4)在一定温度下,若将4a mol H2和2amol N2放入2L的密闭容器中,充分反应后测得N2的转化率为50%,则该反应的平衡常数为 。若此时再向该容器中投入a mol H2、amol N2和2amol NH3,判断平衡移动的方向是 (“正向移动”“ 逆向移动”或“不移动”)
(5)将上述实验中产生的NH3通入到0.04mol·L-1的FeCl3溶液中,要使溶液中Fe3+沉淀较完全(即Fe3+浓度降至原来的千分之一),则溶液的pH为 (已知常温下,Fe(OH)3的溶度积常数Ksp=4×10-38)
27. (15分)下图涉及的物质所含元素中,除一种元素外,其余均为短周期元素。已知:A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列出)。请回答下列问题:
(15分)下图涉及的物质所含元素中,除一种元素外,其余均为短周期元素。已知:A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列出)。请回答下列问题:
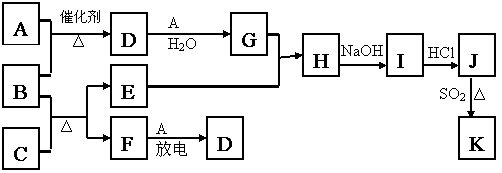
(1)B的电子式为 ;
(2) 写出B和C反应的化学方程式 ;
(3)写出E与G的稀溶液的离子方程式,并标出电子转移数目:
;
(4)J、K均是同种金属的氯化物,且K为白色沉淀。写出SO2还原J生成K的离子方程式 ;
(5)汽车尾气中常含有D和CO ,二者在催化剂作用下可以大部分转化为两种对空气无污染的物质,已知: F(g) + A(g) = 2D (g) △H = +180.5KJ/mol
2C (s)+ O2
(g)= 2CO(g) △H = -221.0 KJ/mol
-221.0 KJ/mol
C (s)+ O2(g) = CO2(g) △H = -393.5 KJ/mol
则上述尾气转化的热化学方程式为: 。
26. (14分)用下图装置可以进行测定SO2转化成SO3的转化率的实验。已知SO3的熔点是16.8℃,沸点是445.8℃。已知发生装置中所涉及反应的化学方程式为:
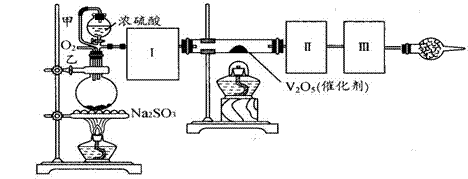 Na2SO3(s) + H2SO4(98%)==Na2SO4
+ H2O + SO2↑
Na2SO3(s) + H2SO4(98%)==Na2SO4
+ H2O + SO2↑
(1)根据实验需要,应该在Ⅰ、Ⅱ、Ⅲ处连接合适的装置。请从下图A-E装置中选择最适合装置并将其序号填入下面的空格中。
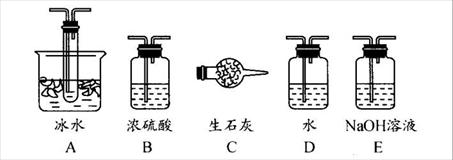 Ⅰ、Ⅱ、Ⅲ处连接的装置分别是_______________、_______________、_______________。
Ⅰ、Ⅱ、Ⅲ处连接的装置分别是_______________、_______________、_______________。
(2)从乙处均匀通入O2,为使SO2有较高的转化率,实验中在加热催化剂与滴加浓硫酸的顺序中,应采取的操作是 。
(3)将SO2通入含1.5mol氯酸的溶液中,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式
(4)用amolNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,测得装置Ⅲ增重了bg,则实验中SO2的转化率为 %(用含a、b的代数式填写)
(5)尾端球形干燥管的作用是 。
13.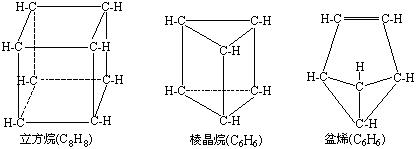 近年来用合成方法制备了多种新奇的有机物,例如分子具有如下图所示立体结构的环状化合物:
近年来用合成方法制备了多种新奇的有机物,例如分子具有如下图所示立体结构的环状化合物:
有人认为上述有机物中①立方烷、棱晶烷可以看做是烷烃的同系物;②盆烯是乙烯的同系物;③棱晶烷、盆烯是苯的同分异构体。上述看法中正确的是( )
A.②③ B.除①都正确 C.只有① D.只有③
12. 从下列事实所得出的相应结论正确的是( )
|
|
实验事实 |
结论 |
|
① |
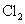 的水溶液可以导电 的水溶液可以导电 |
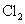 是电解质 是电解质 |
|
② |
将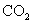 通入到 通入到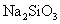 溶液中产生白色浑浊 溶液中产生白色浑浊 |
酸性: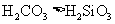 |
|
③ |
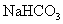 溶液与 溶液与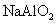 溶液混合产生白色沉淀 溶液混合产生白色沉淀 |
酸性: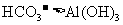 |
|
④ |
常温下白磷可自燃而氮气须在放电时才与氧气反应 |
非金属性: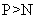 |
|
⑤ |
某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 |
该溶液一定有 NH4+ |
A.③④⑤ B.②③⑤ C.①②③ D.全部
11.下列各组物质间反应可能包括多步反应,其总的离子方程式正确的是
A. NaClO 溶液中通入过量SO2:ClO -+SO2 + H2O == HClO + HS03- B. 甲醇、氧气和氢氧化钾溶液组成的燃料电池的负极反应
CH3OH+H2O-6e-= CO2↑+6H+
C. AlCl3 溶液中投入过量Na:Al3+ + 4Na+2H2O ==AlO2 - +4Na+ + 2H2 ↑
D.向明矾溶液中滴加Ba(OH)2 ,恰好使SO42- 沉淀完全:
2Al3++3S04 2-+ 3Ba2+ + 6OH - == 2Al(OH)3↓+ 3BaSO4↓
10. 在密闭容器中,反应X2(g)+
Y2(g) 2XY(g);△H<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,图中对此过程的分析正确的是。
在密闭容器中,反应X2(g)+
Y2(g) 2XY(g);△H<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,图中对此过程的分析正确的是。
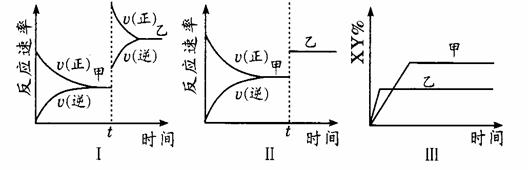
曲线图
A.图I是加入适当催化剂的变化情况
B.图Ⅱ是扩大容器体积的变化情况
C.图Ⅲ是增大压强的变化情况
D.图Ⅲ是升高温度的变化情况
9. t℃ 时,水的离 子积为Kw ,该温度下将 a mol/L 一元酸 HA 与b mol/L一元碱BOH 等体积混合,若混合后溶液呈中性,下列说法一定正确的是
子积为Kw ,该温度下将 a mol/L 一元酸 HA 与b mol/L一元碱BOH 等体积混合,若混合后溶液呈中性,下列说法一定正确的是
A.混合液中,[H+]
=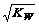 B.混合液的pH = 7 C.混合液中,
B.混合液的pH = 7 C.混合液中,
c(B+)= c(A-)+ c(OH-) D.a = b
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com