
5.燃烧热与中和热
1)燃烧热
(1)概念:在101kPa时,1mol物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。燃烧热的单位一般用kJ/mol表示。
注意:完全燃烧,是指物质中下列元素完全转变成对应的物质:C→C02,H→H20,S→S02等。
(2)表示的意义:例如C的燃烧热为393.5kJ/mol,表示在101kPa时,1molC完全燃烧放出393.5kJ的热量。
2)中和热
(1)概念:在稀溶液中,酸跟碱发生中和反应而生成 1 molH20,这时的反应热叫中和热。
(2)中和热的表示:H+(aq)+OH-(aq)=H2O (1); △H=-57.3kJ/mol。
3)使用化石燃料的利弊及新能源的开发
(1)重要的化石燃料:煤、石油、天然气
(2)煤作燃料的利弊问题
①煤是重要的化工原料,把煤作燃料简单烧掉太可惜,应该综合利用。
②煤直接燃烧时产生S02等有毒气体和烟尘,对环境造成严重污染。
③煤作为固体燃料,燃烧反应速率小,热利用效率低,且运输不方便。
④可以通过清洁煤技术,如煤的液化和气化,以及实行烟气净化脱硫等,大大减少燃煤对环境造成的污染,提高煤燃烧的热利用率。
(3)新能源的开发
①调整和优化能源结构,降低燃煤在能源结构中的比率,节约油气资源,加强科技投入,加快开发水电、核电和新能源等就显得尤为重要和迫切。
②最有希望的新能源是太阳能、燃料电池、风能和氢能等。这些新能源的特点是资源丰富,且有些可以再生,为再生性能源,对环境没有污染或污染少。
●理解中和热时注意:
①稀溶液是指溶于大量水的离子。②中和热不包括离子在水溶液中的生成热、电解质电离的吸热所伴随的热效应。③中和反应的实质是H+和OH-化合生成 H20,若反应过程中有其他物质生成,这部分反应热也不在中和热内。
|

[例1](2010山东卷,10)下列与化学反应能量变化相关的叙述正确的是
A 生成物能量一定低于反应物总能量
B 放热反应的反应速率总是大于吸热反应的反应速率
C 英语盖斯定律,可计算某些难以直接侧脸房的反应焓变
D 同温同压下,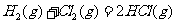 在光照和点燃条件的
在光照和点燃条件的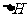 不同
不同
解析:生成物的总能量低于反应总能量的反应,是放热反应,若是吸热反应则相反,故A错;反映速率与反应是吸热还是放热没有必然的联系,故B错;C是盖斯定律的重要应用,正确;根据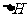 =生成物的焓-反应物的焓可知,焓变与反应条件无关,故D错。
=生成物的焓-反应物的焓可知,焓变与反应条件无关,故D错。
答案:C
[例2](2010广东理综卷,31)
硼酸(H3BO3)在食品、医药领域应用广泛。
(1)请完成B2H6气体与水反应的化学方程式:B2H6 + 6H2O=2H3BO3 +________。
(2)在其他条件相同时,反应H3BO3 +3CH3OH B(OCH3)3 +3H2O中,H3BO 3的转化率(
B(OCH3)3 +3H2O中,H3BO 3的转化率(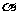 )在不同温度下随反应时间(t)的变化见图12,由此图可得出:
)在不同温度下随反应时间(t)的变化见图12,由此图可得出:
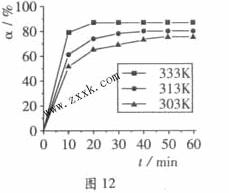
①温度对应该反应的反应速率和平衡移动的影响是____ ___
②该反应的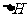 _____0(填“<”、“=”或“>”).
_____0(填“<”、“=”或“>”).
(3)H3BO 3溶液中存在如下反应:
H3BO
3(aq)+H2O(l) [B(OH)4]-( aq)+H+(aq)已知0.70 mol·L-1
H3BO 3溶液中,上述反应于298K达到平衡时,c平衡(H+)=2. 0 × 10-5mol·L-1,c平衡(H3BO 3)≈c起始(H3BO 3),水的电离可忽略不计,求此温度下该反应的平衡常数K(H2O的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)
[B(OH)4]-( aq)+H+(aq)已知0.70 mol·L-1
H3BO 3溶液中,上述反应于298K达到平衡时,c平衡(H+)=2. 0 × 10-5mol·L-1,c平衡(H3BO 3)≈c起始(H3BO 3),水的电离可忽略不计,求此温度下该反应的平衡常数K(H2O的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)
解析:(1)根据元素守恒,产物只能是H2, 故方程式为B2H6 + 6H2O=2H3BO3 +6H2。
(2)由图像可知,温度升高,H3BO 3的转化率增大,故升高温度是平衡正向移动,正反应是吸热反应,△H>O。
(3) K=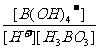 =
=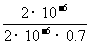 =
=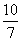
答案:
(1) B2H6 + 6H2O=2H3BO3 +6H2
(2) ①升高温度,反应速率加快,平衡正向移动 ②△H>O
(3) 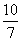 或1.43
或1.43
[例3](2010重庆卷,12)已知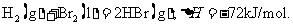 蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:

则表中a为
A.404 B.260 C.230 D.200
答案D
[解析]本题考查盖斯定律的计算。由已知得:Br2(l)=Br2(g) DH=+30KJ/mol,则H2(g) + Br2(g) = 2HBr(g);DH= -102KJ/mol。436+a-2×369=-102;a=-200KJ,D项正确。
|

第2课时 热化学方程式
4.燃料充分燃烧的两个条件
(1)要有足够的空气
(2)燃料与空气要有足够大的接触面。
3.化学反应中的能量变化示意图对于该“示意图”可理解为下列形式:
 由能量守恒可得:
由能量守恒可得:
反应物的总能量:生成物的总能量+热量(放热反应)
反应物的总能量:生成物的总能量-热量(吸热反应)
2.放热反应和吸热反应
(1)放热反应:即有热量放出的化学反应,其反应物的总能量大于生成物的总能量。
(2)吸热反应:即吸收热量的化学反应,其反应物的总能量小于生成物的总能量。
1.定义:化学反应过程中所释放或吸收的能量,都可以热量(或转换成相应的热量)来表示,称为焓变(ΔH),单位:kJ/mol 或 kJ•mol-1
在化学反应中,旧键的断裂需
要吸收能量 ,而新键的形成则放出能量。总能量的变化取决于上述两个过程能量变化
的相对大小。
任何一个化学反应中,反应物所具有的总能量与生成物所具有的总能量总不会相等的。
在新物质产生的同时总是伴随着能量的变化。
注意:
(1) 反应热和键能的关系
例如:1molH2和1molCl2反应生成2molHCl的反应热的计算。
1moLH2分子断裂开H—H键需要吸收436kJ的能量;1molCl2分子断裂开Cl—Cl键需要
吸收243kJ的能量,而2molHCl分子形成2molH—Cl键放出431kJ·mol-1×2mol=862kJ
的能量,所以,该反应H2(g)+Cl2(g)=2HCl(g)的反应热
△H===生成物分子形成时释放的总能量—反应物分子断裂时所需要吸收的总能量
===862kJ·mol--436 kJ·mol-1-243 kJ·mol—1
===183kJ·mol-1
由于反应后放出的能量使反应本身的能量降低,故规定△H=反应物的键能总和—生成物
的键能总和
(2)反应焓变与反应条件的关系
焓是科学家们为了便于计算反应热而定义的一个物理量,它的数值与物质具有的能量有
关。对于一定量的纯净物质,在一定的状态(如温度、压强)下,焓有确定的数值。在
同样的条件下,不同的物质具有的能量也不同,焓的数值也就不同;同一物质所处的环
境条件(温度、压强)不同,以及物质的聚集状态不同,焓的数值也不同。焓的数值的
大小与物质的量有关,在相同的条件下,当物质的物质的量增加一倍时,焓的数值也增
加一倍。因此,当一个化学放映在不同的条件下进行,尤其是物质的聚集状态不同时,
反应焓变是不同的。
3、盖斯定律:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关。这就是盖斯定律。利用盖斯定律可以间接计算反应热。
例如:C(s)+O2(g)=CO2(g);△H1
C(s)+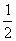 O2(g)=CO(g);△H2
CO(g)+
O2(g)=CO(g);△H2
CO(g)+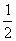 O2(g)=CO2(g);△H3
O2(g)=CO2(g);△H3
依盖斯定律有:△H1=△H2+△H3。

第1课时 化学反应的焓变
2、吸热反应:反应物所具有的总能量小于生成物所具有的总能量,热量的多少等于生成物具有的总能量与反应物具有的总能量的差值。常见的吸热反应有:水解反应、结晶水合物失水的反应、碳与二氧化碳或与水蒸气的反应等
物质的能量越低,性质就越稳定;物质的能量越高,性质就越活泼。物质的化学能是化学键的能量,通过化学键的键能可计算反应热。
如:反应H2(g)+Cl2(g)=2HCl(g);△H。△H == E(H-H)+E(Cl-Cl)-2E(H-Cl)。
1、放热反应:反应物所具有的总能量大于生成物所具有的总能量,热量的多少等于反应物具有的总能量与生成物具有的总能量的差值。常见的放热反应有:燃烧、中和反应、常温下能自发发生的绝大多数的各类反应。
3、书写热化学方程式注意事项:
a. 注明反应的温度和压强(若在101kPa和298K条件下进行,可不予注明),注明△H的“+”与“-”,放热反应为“-”,吸热反应为“+”。
b. △H写在方程式右边,并用“;”隔开。
c. 必须标明物质的聚集状态(气体用“g”,液体用“l”,固体用“s”,溶液用“aq”)。若用同素异形体要注明名称。
d. 各物质前的计量系数不表示分子数目只表示物质的量的关系。△H与计量数成正比关系。同样的反应,计量系数不同,△H也不同,例如:
2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ·mol-1
H2(g)+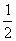 O2(g)=H2O(g);△H=-241.8kJ·mol-1
O2(g)=H2O(g);△H=-241.8kJ·mol-1
上述相同物质的反应,前者的△H是后者的两倍。
燃烧热和中和热:在101kPa时,1mol物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。在稀溶液里,酸跟碱发生中和反应而生成1mol 液态H2O,这时的反应热叫做中和热。燃烧热的热化学方程式强调燃烧物前的计量数为1,中和热强调热化学方程式中水前的计量数为1。燃烧热要强调生成稳定的氧化物,如:生成液态水。
如:H2的燃烧热的热化学方程式:H2(g)+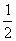 O2(g)=H2O(l);△H=-286kJ·mol-1
O2(g)=H2O(l);△H=-286kJ·mol-1
中和热的热化学方程式:
NaOH(aq)+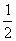 H2SO4(aq)=
H2SO4(aq)=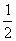 Na2SO4(aq)+H2O(l);△H=-57.3kJ·mol-1
Na2SO4(aq)+H2O(l);△H=-57.3kJ·mol-1
2、影响反应热大小的因素
①反应热与测定条件(温度、压强等)有关。不特别指明,即指25℃,1.01×105Pa(101kPa)测定的。中学里热化学方程式里看到的条件(如:点燃)是反应发生的条件,不是测量条件。
②反应热的大小与物质的集聚状态有关。
③反应热的大小与物质的计量数有关。
在反应:2H2(g)+O2(g)=2H2O(g);△H1=-a kJ·mol-1中,2molH2燃烧生成气态水放出的热量a kJ,该反应的反应热是a kJ·mol-1,该反应的△H是-a kJ·mol-1。注意这三个单位。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com