
3.若函数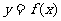 的图象与函数
的图象与函数 的图象关于
的图象关于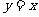 对称,则
对称,则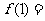 ( )
( )
A.1 B.-1 C.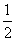 D.
D.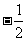
2.已知单位向量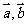 满足
满足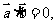 则
则 的值为( )
的值为( )
A.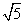 B.5 C.1 D.
B.5 C.1 D.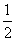
1.已知集合 则
则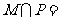 ( )
( )
A.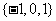 B.
B.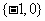 C.
C.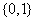 D.
D.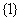
23.CO、CH4均为常见的可燃性气体。
(1)等体积的CO和CH4在相同条件下分别完全燃烧,转移的电子数之比是 。
(2)已知在101 kPa时,CO的燃烧热为283 kJ/mol。相同条件下,若2 molCH4完全燃烧生成液态
水,所放出的热量为1 mol CO完全燃烧放出热量的6.30 倍,CH4完全燃烧反应的热化学方程式是: 。
(3)120℃、101 kPa下,a mL由CO、CH4组成的混合气体在bmL O2中完全燃烧后,恢复到原温
度和压强。
① 若混合气体与O2恰好完全反应,产生b mL CO2,则混合气体中CH4的体积分数为
(保留2位小数)。
② 若燃烧后气体体积缩小了a/4 mL ,则a与b关系的数学表示式是 。
22、在101kPa时,H2在1.00molO2中完全燃烧生成2.00mol液态H2O。 (1)放出571.6kJ的热量,H2的燃烧热为________,表示H2燃烧热的热化学方程式为____________。 (2)1.00L 1.00mol/L H2SO4溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,该反应的中和热为___________,表示其中和热的热化学方程式为____________________。
20、称取等质量为(ag)胆矾两份。把一份溶于bg水中,测知其溶解时吸收Q1kJ热量;把另一份脱水后溶于bg水中,测得其溶解时放热Q2kJ。
(1)胆矾的溶解热为______kJ·mol—1,是______(填”吸热”或“放热”)
(2)无水硫酸铜的溶解热为______kJ·mol—1,是______过程。
(3)从以上数据可知,胆矾脱水是______过程,1mol胆矾脱水需______kJ·mol—1热量。
21、目前大部分城市居民所使用的燃料主要是管道煤气,使用天然气作为居用燃料对环境更为有利。管道煤气的主要成分是CO、H2和少量烃类,天然气的主要成分是CH4。它们的燃烧反应如下:
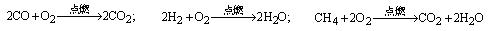 根据以上化学方程式判断:燃烧相同体积的管道煤气和天然气,消耗空气体积较大的是_________。因此燃烧管道煤气的灶具如需改烧天然气,灶具的改进方法是_________进风口(填增大或减小),如不作改进可能产生的不良结果是_________________。管道煤气中含有的烃类,除甲烷外,还有少量乙烷、丁烷等,它们的某些性质见下表:
根据以上化学方程式判断:燃烧相同体积的管道煤气和天然气,消耗空气体积较大的是_________。因此燃烧管道煤气的灶具如需改烧天然气,灶具的改进方法是_________进风口(填增大或减小),如不作改进可能产生的不良结果是_________________。管道煤气中含有的烃类,除甲烷外,还有少量乙烷、丁烷等,它们的某些性质见下表:
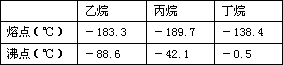
试根据以上某个关键数据解释冬天严寒的季节有时管道煤气火焰很小,并且呈断续状态的原因是 _______________________。
18、0.3mol气态高能燃料乙硼烷(分子式B2H6),在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ的热量,则其热化学方程式为________________。又已知H2O(l)=H2O(g);△H=44kJ·mol-1,则11.2L标准状况下的乙硼烷完全燃烧生成气态水时放出的热量是_________kJ。 19、如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中。试回答下列回答:

(1)实验中观察到的现象是____________________。 (2)产生上述现象的原因是____________________。 (3)写出有关反应的离子方程式________________。 (4)由实验推知,MgCl2溶液和H2的总能量________(填“大于”“小于”“等于”)镁片和盐酸的总能量。
57.3kJ/mol,向1L0.5mol·L-1的NaOH溶液中加入下列物质:①稀醋酸;②浓H2SO4;
③稀硝酸,恰好完全反应的热效应△H1、△H2、△H3的关系正确的是( ) A.△H1>△H2>△H3 B. △H1<△H3<△H2 C.△H1=△H3>△H2 D.△H1>△H3>△H2 14、对下列化学反应热现象,不正确的说法是( ) A.放热的反应发生时不必加热
B.化学反应一定有能量变化
C.化学反应一般地说,吸热反应需要加热后才能发生
D.化学反应热效应数值与反应物质多少有关
15、以NA代表阿伏加德罗常数,则关于热化学方程式C2H2(g)+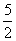 O2=2CO2(g)+H2O(l);△H=-1300kJ/mol的说法中,正确的是( )
A.有10NA个电子转移时,该反应放出1300kJ的能量
B.有NA个水分子生成且为液体时,吸收1300kJ的能量
C.有2NA个碳氧共用电子对生成时,放出1300kJ的能量
D.有8NA个碳氧共用电子对生成时,放出1300kJ的能量
16、完全燃烧一定质量的无水乙醇,放出的热量为Q,已知为了完全吸收生成的二氧化碳,消耗掉8mol·L-1的氢氧化钠溶液50mL,则无水乙醇的燃烧热放出的热量不可能是( )
A.10Q B.10Q-5Q C.大于10Q D.小于5Q
17、下列说法正确的是( )
A.需要加热才能发生的反应一定是吸热反应
B.任何放热反应在常温条件下一定能发生反应
C.反应物和生成物所具有的总能量决定了放热还是吸热
D.吸热反应在一定条件下(如常温、加热等)也能发生反应
二、填空题
O2=2CO2(g)+H2O(l);△H=-1300kJ/mol的说法中,正确的是( )
A.有10NA个电子转移时,该反应放出1300kJ的能量
B.有NA个水分子生成且为液体时,吸收1300kJ的能量
C.有2NA个碳氧共用电子对生成时,放出1300kJ的能量
D.有8NA个碳氧共用电子对生成时,放出1300kJ的能量
16、完全燃烧一定质量的无水乙醇,放出的热量为Q,已知为了完全吸收生成的二氧化碳,消耗掉8mol·L-1的氢氧化钠溶液50mL,则无水乙醇的燃烧热放出的热量不可能是( )
A.10Q B.10Q-5Q C.大于10Q D.小于5Q
17、下列说法正确的是( )
A.需要加热才能发生的反应一定是吸热反应
B.任何放热反应在常温条件下一定能发生反应
C.反应物和生成物所具有的总能量决定了放热还是吸热
D.吸热反应在一定条件下(如常温、加热等)也能发生反应
二、填空题
11、在同温同压下,下列各组热化学方程式Q2>Q1的是( )
A.2H2(g)+O2(g)=2H2O(l);△H=-Q1 2H2(g)+O2(g)=2H2O(g);△H=-Q2
B.S(g)+O2(g)=SO2(g);△H=-Q1 S(s)+O2(g)=SO2(g);△H=-Q2
C.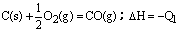 C(s)+O2(g)=CO2(g);△H=-Q2
D.H2(g)+Cl2(g)=2HCl(g);△H=-Q1
C(s)+O2(g)=CO2(g);△H=-Q2
D.H2(g)+Cl2(g)=2HCl(g);△H=-Q1 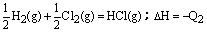 12、100gC不完全燃烧所得产物中,CO所占体积为1/3,CO2为2/3,且:
12、100gC不完全燃烧所得产物中,CO所占体积为1/3,CO2为2/3,且:
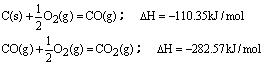 与这些碳完全燃烧相比,损失的热量为( )
A.39.292kJ B.3274.3kJ C.784.92kJ D.2489.44kJ
13、强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(l);△H=-
与这些碳完全燃烧相比,损失的热量为( )
A.39.292kJ B.3274.3kJ C.784.92kJ D.2489.44kJ
13、强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(l);△H=-
10、某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):
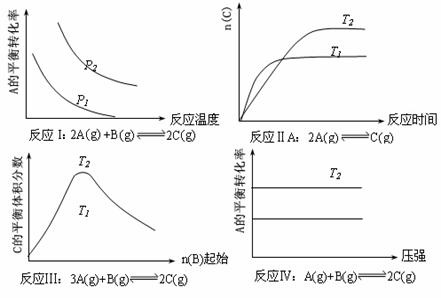
根据以上规律判断,下列结论正确的是
A.反应Ⅰ:△H>0,P2>P1 B.反应Ⅱ:△H<0,T1>T2
C.反应Ⅲ:△H>0,T2>T1;或△H<0,T2<T1 D.反应Ⅳ:△H<0,T2>T1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com