
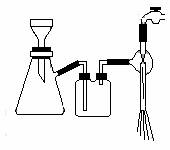
28.不同物质的溶解度会随温度的变化而发生不同的变化,利用这一性质,我们可以将物质进行分离和提纯,工业上制取硝酸钾就是利用了该原理,下表为几种不同的盐在水中溶解度表
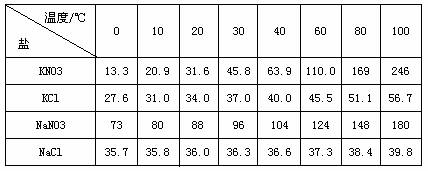 硝酸钾等四种盐在不同温度下的溶解度
硝酸钾等四种盐在不同温度下的溶解度
(1)实验原理:NaNO3 + KCl ===NaCl + KNO3,该反应是可逆的,因此可以改变反应条件使反应向右进行。
(2)仪器:量筒、烧杯、托盘天平、硬质试管、酒精灯、石棉网、三角架、铁架台、热滤漏斗、、抽气泵、蒸发皿、坩埚钳、滤纸、火柴、药匙
固体药品:硝酸钠(工业级)、氯化钾(工业级)
液体药品:AgNO3(0.1mol·L-1)、硝酸(1mol·L-1)、蒸馏水
实验中还需要的玻璃仪器为______________________
(3)KNO3晶体制备流程如下图所示:

实验中②对应的操作是__________,②中采用此操作的主要目的是___________________________操作④和⑧为________,采用此操作的优点是_________________________________,上图为此操作示意图,请说明图中存在的错误_______________________________________________________________。
(4)沉淀B中主要成份为__________所得粗产品中含有较多杂质,检验所得产品中是否Cl-的方法是________________________________,热过滤时,承接滤液的烧杯中先加2mL蒸馏水,主要目的是______________________________________。
(5)蒸发操作对实验影响较大,如果液体蒸发太少则_________________________________,反之如果液体蒸发过多则___________________________________________。
27.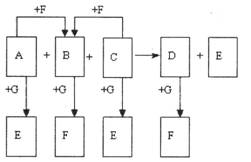 (10分)已知右图中所有物质均为化合物,A、 C的水溶液呈碱性,且C是一种强碱,F、G的水溶液呈酸性。B为红褐色沉淀,化合物G在常温下呈气态,其水溶液是一种常见的强酸,A、C、D、E焰色反应呈黄色。A、D的水溶液都有杀菌消毒作用。 A、B、C反应时,物质的量之比为3:2:4。其它物质相互间的转化关系如图所示(各反应在常温下即可发生;多数反应的生成物没有写完整)。请写出:(1)A的化学式_________,C的电子式:_______________;
(10分)已知右图中所有物质均为化合物,A、 C的水溶液呈碱性,且C是一种强碱,F、G的水溶液呈酸性。B为红褐色沉淀,化合物G在常温下呈气态,其水溶液是一种常见的强酸,A、C、D、E焰色反应呈黄色。A、D的水溶液都有杀菌消毒作用。 A、B、C反应时,物质的量之比为3:2:4。其它物质相互间的转化关系如图所示(各反应在常温下即可发生;多数反应的生成物没有写完整)。请写出:(1)A的化学式_________,C的电子式:_______________;
(2)A、B、C三者发生反应的离子方程式:__________________________
(3)已知D和G反应时还有使带火星的木条复燃的气体产生,则D和G反应的化学方
程式为:____________________________________。
26.(12分)金属钛被誉为“二十一世纪金属”,有“生物金属,海洋金属,太空金属”美称;具有低密度、高强度,耐腐蚀、耐高温,记忆能力等优良性能。金属钛的制备主要包括下面几个步骤:
①用硫酸溶解钛铁精矿(FeTiO3),溶解后水浸、冷却、结晶得到副产品绿矾;
②所得滤液水解充分后得到沉淀A和稀硫酸,稀硫酸循环利用;
③高温煅烧沉淀A得到化合物B,B是重要的白色颜料;
④化合物B与焦炭在高温条件下氯化时得到化合物C和一氧化碳气体,其中C在常温下呈液态,且极易水解,可以用作军事烟雾剂;
⑤高温下用金属镁还原C得到金属钛。
(1)金属钛在加热时可以与浓NaOH溶液作用,写出钛与热的浓碱作用时的离子方程式:
_________________________________;写出主族金属元素中与此相似的一个离子反应方程式:_____________________________________。
(2)写出第④步的化学反应方程式____________________________。
(3)用化学方程式表示C为什么可以用作军事烟雾剂:_________________________。
13.研究性学习小组进行了一系列化学实验后,发现高锰酸钾分解后的含锰元素的化合物都能和浓盐酸反应制得氯气,且锰化合物的还原产物都是MnCl2。他们将6.32gKMnO4粉末加热一段时间,也不知道高锰酸钾是否完全分解,收集到0.112L气体后便停止加热了,冷却后放入足量的浓盐酸再加热,又收集到气体体积是(上述气体体积都折合成标准状况)
A . 0.448L B. 2.240L C.2.016L D.无法确定
12. 如图所示,向A和B中都充入2molX和2molY,起始VA=0.8aL,VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应x(g)+Y(g) 2Z(g)+w(g),达到平衡时,VA=0.9 aL,则下列说法错误的是
如图所示,向A和B中都充入2molX和2molY,起始VA=0.8aL,VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应x(g)+Y(g) 2Z(g)+w(g),达到平衡时,VA=0.9 aL,则下列说法错误的是
A.两容器中达到平衡的时间A<B
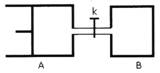 B.A容器中X的转化率为25%,且比B容器中X的转化率小
B.A容器中X的转化率为25%,且比B容器中X的转化率小
C.打开K一段时间达平衡时,A的体积为0.8aL(连通管中气体体积不计);
D.打开K达新平衡后,升高B容器温度,A容器体积一定增大
11.酸A是某抗氧化剂成分之一,A与FeCl3溶液反应显紫色,A能使Br2-CCl4溶液褪色。
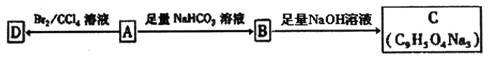
现已知A中苯环上含有三个取代基,则A的可能结构有
A.6种 B.9种 C. 12种 D.15种
10.设NA代表阿伏加德罗常数的数值,下列说法中正确的是
①常温常压下,9g甲烷(HCH4)所含的中子数为5NA
②常温常压下,22.4L N2气体的分子数小于NA
@64g的铜发生氧化还原反应,一定失去2NA个电子
④常温常压下,100mL 0.5mol/L的乙酸溶液中,乙酸的分子数目小于0.05NA
⑤标准状况时,22.4L二氯甲烷所含有的分子数为NA
⑥常温常压下,1mol氦气分子含有的核外电子数为4NA。
A.①② B.③④ c.②④ D.⑤⑥
9.科学家P.Tatapudi等人首先使用在空气中电解纯水(酸性条件下)的方法制得臭氧。同时还得到了过氧化氢,下列电极反应式正确的是
A.阳极反应:3O2+6H++6e-=3H2O2
B.阳极反应:3H2O一6e-=O3+6H+
C.阴极反应:3O2+6H2O+6e-=3H2O2+6OH-
D.阴极反应:3H2O一6e-=O3+6H+
8.有关下图及实验的描述正确的是
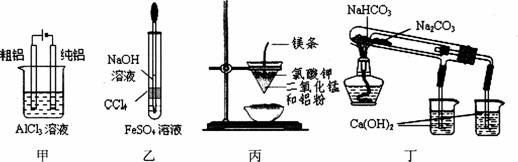
A.用甲图装置电解精炼铝 B.用乙图装置制备Fe(OH)2
C.丙图装置可制得金属锰,用同样的装置可制得金属铬
D.丁图验证NaHCO3和Na2CO3热稳定性
7. 生活中碰到的某些问题,常需要用化学知识解释,下列说法不正确的是
A.牙膏里填充少量的甘油,是由于甘油有吸湿性。
B.药皂中掺入少量的苯酚,是由于苯酚有杀菌作用
C.食盐中加入少量碘酸钾,人食用后可补充人体内碘元素的不足
D.腌制火腿时,添加少量NaNO2,是为了使火腿肉的味道更加美味可口
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com